Введение
Разработка клеточных систем, максимально приближенных к реальным условиям, для in vitro исследований механизмов развития рака шейки матки (РШМ) и тестирования потенциальных терапевтических агентов для его лечения, является актуальной задачей (Fan, 2017). Стандартные клеточные линии РШМ, поддерживаемые в культуре уже на протяжении многих лет, не являются репрезентативными моделями первичных опухолей, что имеет большое количество экспериментальных подтверждений. Например, обнаружено, что при получении постоянных линий РШМ клеточный транскриптом претерпевает более значительные изменения относительно первичных опухолей, чем при естественной трансформации нормальных эпителиальных клеток в опухолевые (Magaldi, 2012). Важность этой задачи можно проиллюстрировать также тем, что канцерогенез РШМ и других вирус-ассоциированных онкопатологий обусловлен, как правило, не определенными «драйверными» мутациями, а процессом случайной интеграции папилломавируса (ВПЧ) в геном клетки-хозяина, в результате чего генетический и фенотипический «портрет» РШМ может варьировать в достаточно широких пределах. Использование лабораторных животных для моделирования патогенеза РШМ, несмотря на их незаменимость в некоторых случаях, также имеет ряд ограничений по причине строгой видовой и тканевой специфичности ВПЧ.
Культивирование первичных клеток цервикальных интраэпителиальных неоплазий (ЦИН) и инвазивного РШМ до сих пор не является тривиальной и простой задачей и по-прежнему нуждается в оптимизации методов и условий (Bononi, 2012; Liu, 2016). В течение долгого времени усилия были направлены на поиск способа культивирования цервикальных кератиноцитов в отсутствие фидерного слоя (используемого в протоколе, опубликованном Stanley и соавт. в 2002 г.), с целью избежать контаминации целевой культуры мышиными фибробластами. Разработка специализированных бессывороточных сред и использование покрытия из компонентов межклеточного матрикса позволило улучшить выход колоний эпителиальных клеток из первичных опухолей РШМ. Тем не менее, полученные временные культуры часто содержат существенное количество стромальных фибробластов, которые, несмотря на создание селективных для кератиноцитов условий, могут пролиферировать с большей скоростью и постепенно замещать кератиноциты (Koopman, 1999; Liu, 2013). В то же время, обсуждается возможность и потенциальные преимущества со-культивирования цервикальных опухолевых кератиноцитов и опухоль-ассоциированных фибробластов (Bononi, 2012).
Материалы и методы
Процесс получения временной культуры первичных опухолевых клеток РШМ состоит из нескольких этапов, по каждому из которых возможно варьирование условий для оптимизации процесса культивирования цервикальных кератиноцитов. В нашем случае была использована комбинация различных подходов, опубликованных ранее другими исследователями; описание и обоснование выбора этих подходов приводится в данном разделе.
- Образцы биоматериала. Образцы опухолевой ткани были получены в ходе операции тотальной гистерэктомии от пациенток ГБУЗ МЗ РК «Республиканский онкологический диспансер» с инвазивным раком шейки матки FIGO-стадий IB и IIB. Транспортировка образцов осуществлялась в стерильных контейнерах в среде DMEM-F12, содержащей 5% фетальной сыворотки теленка (FBS) и коктейль антибиотиков (Gibco), при +4°С в течение не более 2 ч.
- Получение клеточной суспензии. Образцы ткани были разделены на несколько фрагментов и промыты стерильным раствором Хэнкса (Hank's Balanced Salt Solution, HBSS, Gibco); каждый фрагмент был далее разрезан на фрагменты толщиной не более 1-2 мм с помощью стерильного одноразового скальпеля (№10, Sigma-Aldrich). Часть полученных фрагментов – опухолевых эксплантатов - была непосредственно помещена в чашки Петри с обработанной поверхностью для дальнейшего культивирования. Другая часть фрагментов использовалась для получения клеточной суспензии путем ферментативной дезинтеграции с помощью коллагеназы I типа, 50 е.а./мкл (Gibco), в 2 мл HBSS, в присутствии Ca2+, в течение 45-60 мин при +37°С и постоянном вращении (20 об/мин) на мини-ротаторе (BioSan). После инкубации клетки (а также оставшиеся неразрушенные фрагменты) были отмыты центрифугированием в HBSS. Для избавления от эритроцитов (образующихся в большом количестве в результате разрушения внутриопухолевой микрососудистой сети), которые в дальнейшем сильно затрудняют прикрепление клеток к матриксу и их пролиферацию, использовали осмотический шок путем кратковременной (5-7 мин) обработки стерильным аммонийным буфером (Red Blood Cell Lysis buffer: 155 mM NH4Cl, 10 mM KHCO3, 0.1 mM EDTA), после чего клетки отмывали средой для культивирования.
Условия ферментативной диссоциации образцов ЦИН/РШМ могут варьировать: некоторые авторы предлагают использовать коллагеназу II типа в течение ночи при +37°С и 5% СО2 для максимального выхода цервикальных кератиноцитов (Bononi, 2012); Santin и соавт. применяли инкубацию с 0,14% коллагеназой I типа и 0,01% ДНКазой в среде RPMI-1640 при +37°С (в течение 2 ч) или +4°С (в течение ночи) во флаконах большого объема на магнитной мешалке (Santin, 2005). Для получения нормальных цервикальных эпителиоцитов возможно использование диспазы II типа в сочетании с 0.25% трипсином-0.01% EDTA в течение 20 ч (Fan, 2017). Ряд авторов также включают в процесс пробоподготовки фильтрацию полученной суспензии клеток через 150 мкм-нейлоновую сетку с целью получения единичных клеток для их дальнейшего равномерного посева на пластик с определенной плотностью (Santin, 2005; Magaldi, 2012), однако, другие исследователи указывают на отсутствие необходимости данного этапа (Liu, 2016). Мы также не использовали клеточные фильтры перед посевом, так как, согласно нашим наблюдениям, неразрушенные после коллагеназной обработки эпителиальные фрагменты служат таким же важным источником клеточных колоний, как и необработанные эксплантаты (см. далее). Минимальное время ферментативной обработки ткани – до 1 ч – позволяет, согласно нашим наблюдениям, повысить выход жизнеспособных клеток.
- Культивирование. Для культивирования опухолевых клеток РШМ использовали 35 мм-чашки Corning, покрытые коллагеном I типа. Для сравнения, часть клеток была посажена в 12-луночный планшет (TC treated, Eppendorf) с поверхностью, обработанной для культивирования адгезивных культур клеток, но без коллагенового покрытия; однако, на такой поверхности, цервикальные опухолевые кератиноциты (в отличие от фибробластов) были способны закрепляться только после первого пассажа, что совпадает с наблюдениями Liu и соавт. (Liu, 2016).
Все чашки (с опухолевыми эксплантатами или суспензией клеток от каждого образца) были разделены на 2 группы: в одной культивирование проводилось в среде DMEM-F12 с добавлением 1хPSN смеси антибиотиков (пенициллин-стрептомицин-неомицин, Gibco) и 2,5 мкг/мл амфотерицина В (Fungizone, Gibco); в другой группе клетки были помещены в бессывороточную среду для культивирования кератиноцитов (Keratinocyte Serum-Free Medium, K-SFM, Gibco) с тем же содержанием антибиотиков и добавками: 30 мкг/мл бычьего гипофизарного экстракта (BPE) и 5 нг/мл рекомбинантного эпидермального фактора роста человека (rhEGF), согласно инструкции производителя (Gibco). В обоих случаях для первоначального прикрепления клеток и начала роста колоний среда для культивирования содержала 5% FBS; в дальнейшем концентрация фетальной сыворотки была снижена в 2 раза в случае K-SFM, в то время как ее снижение в DMEM-F12 сопровождалось заметным ухудшением роста культуры; поэтому культивирование в DMEM-F12 на всем протяжении эксперимента проводилось в присутствии 5% FBS. Необходимость варьирования содержания сыворотки обусловлена тем, что при высокой ее концентрации (10%) может наблюдаться ускоренный рост фибробластов и дифференцировка («старение») цервикальных кератиноцитов, а в бессывороточной среде кератиноциты, извлеченные из ткани (нормальной или опухолевой), плохо прикрепляются к поверхности и погибают (Bononi, 2012; Liu, 2016). Поэтому рекомендуется посев кератиноцитов проводить при высокой концентрации фетальной сыворотки (5-10%), а после прикрепления клеток снижать ее содержание (до полного отсутствия) (Santin, 2005; Bononi, 2012; Liu, 2013, 2016; Fan, 2017). Для культивирования клеток ЦИН, Bononi и соавт. предлагают комбинировать среды DMEM-F12 и K-SFM в пропорции 1:1, что позволяет получить морфологически гомогенные колонии эпителиальных клеток.
Культивирование проводили в 5% СО2 при +37°С. Первую смену среды осуществляли на 4-е сутки после посева, причем не прикрепившиеся клетки были отсажены в новые чашки. При пересеве, чашки промывали средой без добавок и инкубировали 5-10 мин с 0,05% раствором Трипсина-EDTA при +37°С; после отмывки средой (с 5% FBS) клетки были помещены на 2 ч в стерильные чашки с необработанной поверхностью (при +37°С и 5% СО2); за это время значительная часть фибробластов успевала прикрепиться к пластику (см. далее), а эпителиальные клетки оставались в суспензии и были пересажены в чашки, покрытые коллагеном I. Наблюдение за ростом и морфологией клеток проводили в фазовом контрасте с помощью инвертированного микроскопа CKX41 (Olympus), оборудованного цифровой CCD-камерой, и программного обеспечения cellSens (Olympus).
- Фенотипирование. Подтверждение эпителиальной принадлежности полученной временной культуры клеток было получено путем анализа экспрессии цитокератинов с помощью проточной цитометрии. При достижении 70-80% конфлуетности (0-й пассаж), с поверхности одной из чашек клетки были сняты путем обработки 0,05% раствором Трипсина-EDTA, отмыты средой и далее фосфатно-солевым буфером. После подсчета живых клеток (на TC20 счетчике клеток Bio-Rad), клетки обрабатывали компонентами InsideStain buffer для их фиксации и пермеабилизации согласно инструкции производителя (Miltenyi Biotec) и далее инкубировали с FITC-меченными пан-специфическими антителами к цитокератинам (-7, -8, -18, -19) человека (Miltenyi Biotec). Анализ клеток проводили с помощью проточного цитофлуориметра MACSQuant Analyzer (Miltenyi Biotec) с использованием программного обеспечения MACSQuantify version2.8.
Результаты и обсуждение
- Характеристика роста первичных опухолевых клеток РШМ в культуре. При культивировании клеточной суспензии, полученной путем ферментативной диссоциации образца РШМ IIB стадии, были получены одиночные прикрепившиеся клетки или микро-кластеры, состоящие из двух-трех клеток, которые к концу первой недели приобрели типичную эпителиальную морфологию (Рисунок 1): форма клеток варьировала от прямоугольной до формы «булыжника» («cobblestone»); наблюдались выросты цитоплазмы в форме псевдоподий – в некоторых случаях с хорошо выраженными точечными (фокальными) адгезионными контактами с коллагеновым матриксом. В фазовом контрасте также была очень хорошо заметна зона адгезивных контактов клеток с поверхностью, представленная микрофиламентами (микроворсинками); клетки имели относительно низкое, характерное для кератиноцитов, ядерно-цитоплазматическое соотношение и зернистую цитоплазму. Различные варианты морфологии кератиноцитов приведены на микрофотографиях Рис.1. Если прикрепление кератиноцитов и приобретение ими характерной морфологии происходило в течение всей первой недели (что соответствует срокам, приводимым другими исследователями), то опухоль-ассоциированные фибробласты прикрепились к коллагену в течение 1-ых суток после переноса клеточной суспензии в чашки: как показано на Рис.1Л-М, они характеризовались веретеновидной формой и имели тенденцию располагаться параллельно друг другу.
По сравнению с посевом суспензии одиночных клеток РШМ IIB стадии, посадка на коллагеновый матрикс тканевых эксплантатов РШМ IB стадии, не обработанных коллагеназой, либо прошедших кратковременную (
Сравнение результатов культивирования эксплантатов, не обработанных коллагеназой I, и фрагментов ткани, подвергшихся кратковременной (менее 1 ч) коллагеназной обработке, позволяет говорить о том, что даже если коллагеназа не приводит к полной диссоциации ткани, она, тем не менее, частично деградирует межклеточный матрикс и тем самым облегчает переход клеток из 3D-фрагмента ткани на 2D-поверхность пластика (предварительно покрытую коллагеном). Процесс этого перехода показан на Рисунке 4А: на переднем фронте мигрирующих из эксплантата клеток, перешедших на поверхность пластика, видны хорошо выраженные выросты цитоплазмы. Кроме того, при таком способе обработки клеток наблюдались микроколонии, состоящие не из двух-трех (см. Рис.1), а из порядка 10 клеток с полигональной морфологией, плотно прилегающих друг к другу и с заметными в фазовом контрасте плотными межклеточными контактами, характерными для эпителиальных клеток (Рисунок 4Б).
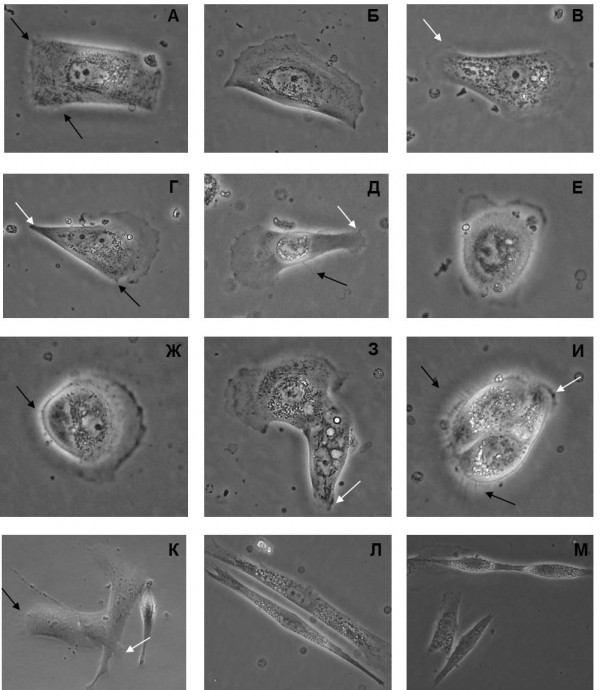
Рисунок 1. Различные варианты морфологии клеток, полученных из первичной опухолевой ткани РШМ IIB, к концу первой недели культивирования на коллагеновом матриксе. А-Б Прямоугольная морфология; В-Д Клетки вытянутой формы с ярко выраженными псевдоподиями; Е-Ж Округлая морфология (форма «булыжника»); З-К Микрокластеры эпителиальных клеток; Л-М Фибробласты, формирующие параллельно ориентированные пучки. Черными стрелками показаны зоны адгезионных клеточных контактов с матриксом в виде микроворсинок, белыми – выпячивания цитоплазмы в форме псевдоподий (ламеллоподий), с областью точечных контактов с матриксом (Г). Увеличение 10х40 (фазовый контраст).
Figure 1. Different variants of morphology of cells derived from the primary tumor tissue of cervical cancer stage IIB and grown on the surface coated with type I collagen (by the end of the 1st week). А-Б Rectangular morphology; В-Д Cells having elongated shape with clearly distinguishable pseudopodia; Е-Ж Round («cobblestone»-like) morphology; З-К Microclusters of epithelial cells; Л-М Fibroblastic cells that formed parallel-oriented bundles. Black arrows indicate zones of cell-matrix junctions (looking as microvilli), white arrows show projections of the cytoplasm in the form of pseudopodia (lamellipodia) that form focal contacts with the coating (Г). Magnification 10х40 (phase contrast).
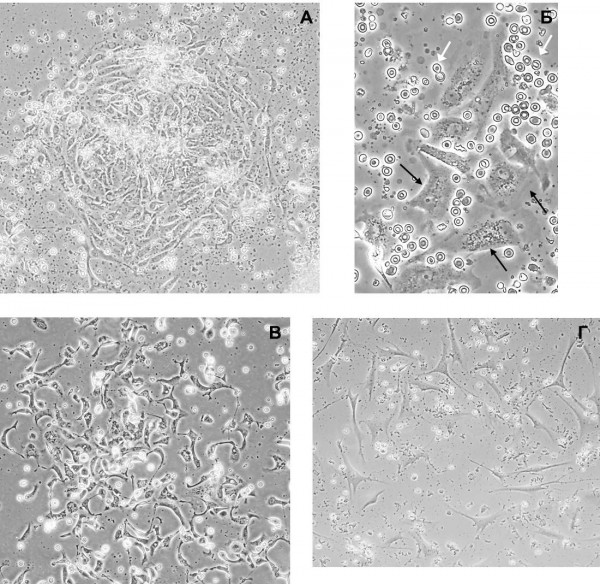
Рисунок 2. Культивирование эксплантатов, полученных из РШМ IB стадии (4-е сутки; фазовый контраст). А Концентрическая колония эпителиальных клеток (увеличение 10х10); Б Фрагмент колонии показан при более крупном увеличении (10х20) – хорошо различима полигональная морфология эпителиальных клеток (обозначена черными стрелками); белыми стрелками показаны эритроциты, присутствовавшие в значительном количестве при культивировании нативных эксплантатов (очевидно, в результате разрушения внутриопухолевых капилляров) и удаленные сразу после прикрепления клеток к матриксу; В Одиночные прикрепившиеся опухолевые эпителиальные клетки; Г Островки диффузно распределенных одиночных фибробластов.
Figure 2. Cultured explants derived from cervical cancer of IB stage (day 4; phase contrast). А A concentric colony of epithelial cells (magnification 10х10); Б A fragment of the colony shown at higher magnification (10х20) – polygonal morphology of epithelial cells (marked by black arrows) is well distinguishable; white arrows indicate erythrocytes that were co-present in a significant amount when culturing native explants (obviously, as a result of destruction of intratumoral microvessels) and were removed immediately after attachment of cells to the matrix; В Individually attached epithelial tumor cells; Г An island of diffusely distributed single fibroblasts.
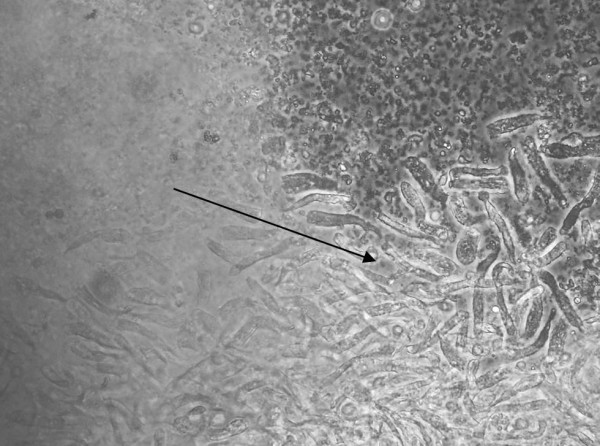
Рисунок 3. Миграция клеток из опухолевого эксплантата: слева (размытое пятно вне фокуса) – экплантат; распространяющиеся из него клетки имеют типичную «мигрирующую» (амебовидную) морфологию (направление миграции показано стрелкой). В непосредственной близости от тканевого фрагмента клетки располагаются в несколько слоев (вертикально), постепенно переходя в монослой.
Figure 3. Migration of cells from the tumor explant (blurred area on the left, out of focus); spreading cells have a typical «migrating» (amoeba-like) morphology (the direction of migration is indicated by an arrow). In the immediate vicinity of the tissue fragment the cells are arranged in several layers (vertically), forming further a monolayer.
По сравнению с РШМ IIB, в результате культивирования эксплантатов РШМ IB уже к концу первой недели удалось получить монослой клеток с >50% конфлуентностью (Рисунок 5); при этом морфология клеток достаточно сильно варьировала; клетки имели как полигональную (уплощенную) форму, так и неправильную, немного вытянутую, что соответствует описаниям, опубликованным Liu и соавт. (Liu, 2016) и Bononi и соавт. (Bononi, 2012). В работе Bononi и соавт. сообщается даже о трех типах клеточной морфологии и, соответственно, трех вариантах образуемых ими колоний, полученных из образов цервикальных интраэпителиальных неоплазий (ЦИН): разделение на данные три типа было проведено на основе различий в форме и размере клеток, ядерно-цитоплазматическом соотношении, плотности межклеточных контактов, возможности вертикального роста; однако, в наших экспериментах такая четкая дифференциация не наблюдалась. Мы также допускаем, что одной их возможных причин того, что для РШМ IB стадии было получен более высокий выход активно пролиферирующих колоний, является более высокая доля некротизированных клеток и иммунного (воспалительного) компонента при РШМ более поздней (IIB) стадии, в результате чего при культивировании РШМ IIB были получены только единичные клетки, которые, вероятно, оказались неспособны к пролиферации в отсутствии контактов с «соседями».
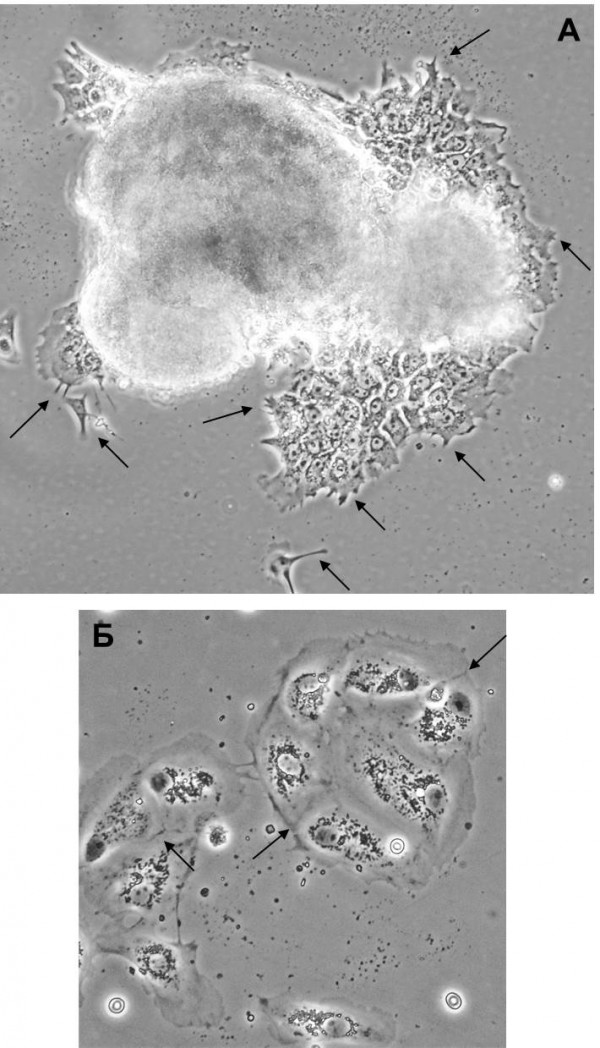
Рисунок 4. А Распространение клеток из эксплантата РШМ IB стадии (5-й/6-й день культивирования): стрелками показаны цитоплазматические выпячивания клеток на мигрирующем («инвазивном») фронте; Б Микроколонии (клеточные кластеры): стрелками показаны зоны плотных межклеточных контактов.
Figure 4. А Spreading of cells from the tissue explant of cervical cancer stage IB (on days 5-6): arrows show cytoplasmic protrusions of cells at the «invasive» (migrating) front; Б Microcolonies (cell clusters): arrows indicate the areas of tight cell-cell junctions.
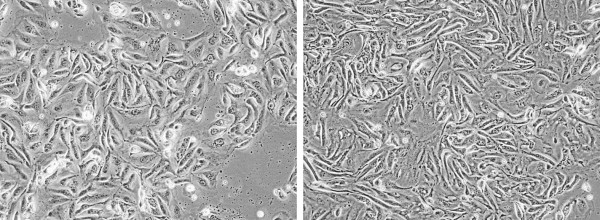
Рисунок 5. Монослой эпителиальных опухолевых клеток, полученных при культивировании тканевых эксплантатов (на 7-е/8-е сутки); показаны два независимых поля зрения микроскопа (увеличение 10х10).
Figure 5. Monolayer of epithelial tumor cells derived from cultured tissue explants on the 7th/8th day; two independent fields of view are presented (10х10 magnification).
Несмотря на вариабельность морфологии, эпителиальные клетки были хорошо различимы с фибробластами, которые через две недели культивирования формировали тяжи (пучки) параллельно ориентированных веретеновидных клеток, окружающие колонии опухолевых клеток (Рисунок 6). Аналогичные наблюдения описаны в работе Bononi и соавт. (Bononi, 2012) для первичной культуры ЦИН2-3. Такой тип роста клеток в смешанной культуре – колонии опухолевых клеток, окруженные тяжами фибробластов – делает принципиально возможным дальнейшую изоляцию эпителиальных клеток с помощью клонирующих цилиндров/колец («cloning rings») и получение гомогенной культуры. Кроме того, как было указано в Материалах и методах, удалить значительную часть фибробластов возможно при пересеве клеток, используя различия в скорости прикрепления кератиноцитов и фибробластов к пластику, в особенности не покрытому коллагеновым матриксом. Как показано на Рисунке 7, в течение 2 ч инкубирования (+37°С, 5%СО2) клеток, снятых с пластика путем трипсинизации, в стерильных чашках, не обработанных коллагеном, значительная доля фибробластов успевает прикрепиться к поверхности и приобрести характерную морфологию, в то время как эпителиальные клетки остаются в суспензии и могут быть далее перенесены на поверхность с коллагеновым покрытием для дальнейшего культивирования. Интересно, что в нашем случае образование тяжей фибробластов наблюдалось в чашках, культивируемых в K-SFM при низком (и даже нулевом) содержании сыворотки, в то время как другие исследователи (Bononi, 2012; Liu, 2016) пишут, что при таких условиях фибробласты прекращают рост и быстро элиминируются из культуры. Возможной причиной этих расхождений является то, что в наших экспериментах стромальные фибробласты были выделены из инвазивных опухолей IB-II стадий (а не ЦИН или нормального эпителия, как в работах Bononi и Liu), и поэтому они могли обладать более агрессивными свойствами и фенотипом, более устойчивым к отсутствию сывороточных факторов роста.
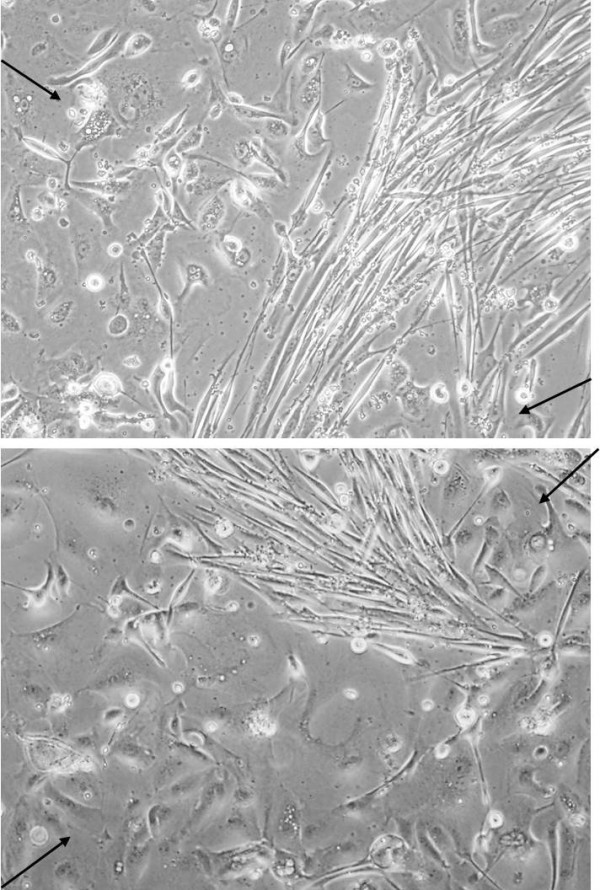
Рисунок 6. Культивировании тканевых эксплантатов (на 14-е сутки): показаны два независимых поля зрения микроскопа; стрелками (справа и слева на каждой фотографии) показаны области колоний опухолевых эпителиальных клеток, разделенные плотными тяжами фибробластов.
Figure 6. A culture of the tumor tissue explant (on the 14th day): two independent fields of view are presented; the areas occupied by epithelial tumor cell colonies (on the right and on the left in both pictures) separated by the tight bundles of fibroblasts are indicated by arrows.
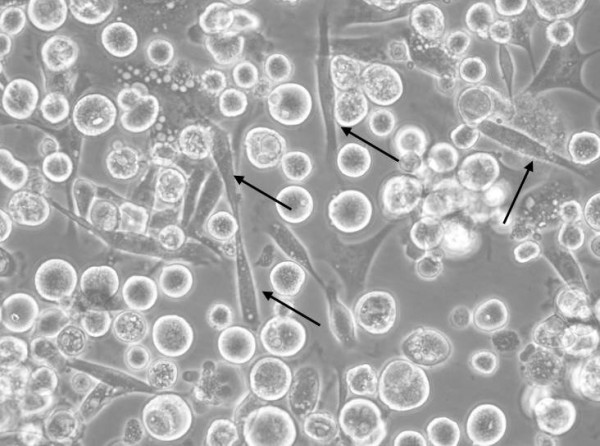
Рисунок 7. Вид клеточной суспензии после трипсинизации и 2ч-инкубации на пластике без покрытия: стрелками показаны прикрепившиеся к поверхности фибробласты.
Figure 7. The appearance of a cell suspension after trypsinization and 2h-incubation on the surface of untreated plastic: the arrows indicate attached fibroblasts.
При культивировании в среде DMEM-F12 в присутствии 5-10% FBS на 3-ей неделе наблюдались признаки «старения» (терминальной дифференцировки) кератиноцитов, проявляющиеся в постепенной вакуолизации цитоплазмы, начиная с возникновения единичных вакуолей (аутофагосом), вплоть до полного замещения ими цитоплазмы (Рисунок 8); в то же время, при культивировании в среде K-SFM (содержащей BPE и rhEGF) подобные явления могли наблюдаться только в центре крупной колонии, а на ее периферии поддерживался активный рост (пролиферация) клеток.
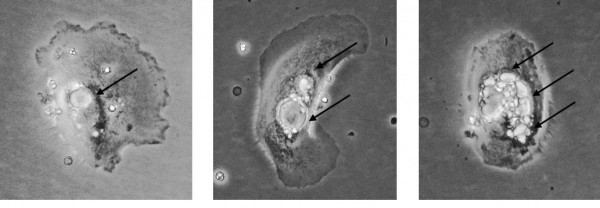
Рисунок 8. Дифференцировка и «старение» кератиноцитов: показаны клетки с разной степенью вакуолизации (от единичных до множественных вакуолей – отмечены стрелками).
Figure 8. Differentiation and «senescence» of cervical keratinocytes: cells with various degree of vacuolization (from single to multiple vacuoles marked by arrows) are displayed.
- Анализ экспрессии цитокератинов. В большинстве упомянутых выше работ, исследователи рассматривают экспрессию цитокератинов как показатель принадлежности первичных клеток, выделенных из РШМ и культивируемых in vitro, к эпителиальному ряду. Цитокератины (ЦК) указывают на происхождение изолируемых клеток из базального и парабазального слоев цервикального эпителия и, соответственно, прогнозируют их высокий пролиферативный потенциал и поддержание свойств стволовых клеток цервикального эпителия при переводе во временную культуру. Авторы в основном анализировали экспрессию ЦK5, ЦK14, ЦK17 и ЦK19, используя иммунофлуоресцентный метод детекции (Bononi, 2012; Liu, 2016) и/или проточную цитометрию (Santin, 2005). Согласно Bononi и соавт. (Bononi, 2012), ЦK14, -17 и -19 детектируются в 100% колоний первичных клеток ЦИН, но возможно варьирование по интенсивности окрашивания (аналогичные данные описаны Liu и соавт.). В нашем случае были использованы пан-специфические меченые антитела к ЦК -7, -8, -18 и ЦК-19, из которых только ЦК-19 перекрывается со спектром ЦК, анализируемых в перечисленных публикациях, однако, для ЦК -7, -8 и -18 также есть опубликованные данные, подтверждающие, что их экспрессия характерна для ЦИН/РШМ и стандартных линий РШМ (Ikeda K, 2008; Sullivan, 2010; Lee H, 2017; Mills, 2017). Для анализа экспрессии цитокератинов в полученной культуре клеток РШМ IB стадии методом цитометрии была выбрана чашка с численным преобладанием клеток эпителиальной морфологии при достижении 70-80% конфлуентности на 0-ом пассаже. Как показано на Рисунке 9, более 50% клеток экспрессировали высокий уровень цитокератинов, что подтверждает их эпителиальную природу.
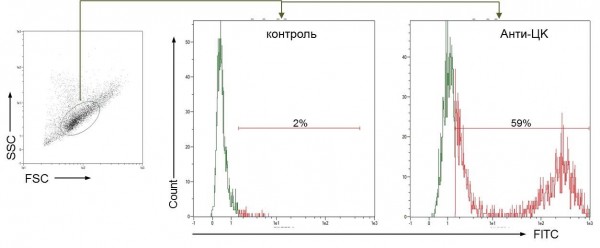
Рисунок 9. Цитометрический анализ экспрессии цитокератинов в первичной культуре клеток РШМ: зеленым цветом обозначен уровень автофлуоресценции неокрашенных клеток (отрицательный контроль), по которому был установлен маркер для ЦК-позитивных клеток (обозначены красным цветом).
Figure 9. Flow cytometric analysis of the expression of cytokeratins in primary cervical cancer cells cultured in vitro: the level of autofluorescence of unstained cells (negative control) is shown in green, the red line corresponds to cytokeratin-positive cells.
Заключение
В целом, для проведения работ с первичными опухолевыми клетками инвазивного РШМ ранних стадий (IB-II) культивирование нативных эксплантатов (либо эксплантатов, кратковременно обработанных матрикс-деградирующим ферментом, т.е. коллагеназой) позволяет получить хороший выход жизнеспособных клеток, быстро формирующих колонии и, в среднем, за 2 недели образующих конфлуентный слой. Культивирование на поверхности, обработанной компонентами межклеточного матрикса (коллагеном и др.), в среде K-SFM с постепенным понижением содержания фетальной сыворотки до 2-3% может рассматриваться как один из возможных оптимальных способов. Схожая с используемой в представленной работе комбинация методик и условий продемонстрирована в исследовании Liu и соавт., направленном на получение клеточных колоний из образцов ЦИН тяжелой степени (Liu, 2016). С помощью данного подхода, с одной стороны, достигается высокая плотность клеток, необходимая для старта пролиферации; с другой стороны, стромальные фибробласты, рассматриваемые как контаминирующие клетки, как правило, исключаются из колоний опухолевых клеток (располагаются на их периферии) и поэтому могут быть далее изолированы (хотя нельзя исключать, что и в условиях in vitro культивирования опухоль-ассоциированные фибробласты продолжают выполнять поддерживающую функцию для опухолевых клеток). Необходимо отметить, что успех получения первичных опухолевых линий РШМ оценивается исследователями, в среднем, в 20-30%: среди осложняющих факторов приводятся контаминация микрофлорой, малое количество опухолевых клеток и их дифференцировка (Koopman, 1999; Magaldi, 2012).
Как видно из представленных выше микрофотографий, морфология клеток, выделенных из инвазивного РШМ ранних стадий, и характеристики их роста в первичной культуре очень гетерогенны, что согласуется с сообщениями других авторов и, очевидно, отражает исходную естественную гетерогенность первичной опухоли (и может рассматриваться как преимущество данной клеточной системы). Другим преимуществом является возможность изучения транскриптома (в том числе при воздействии химических агентов) культуры, обогащенной опухолевыми клетками, сведя при этом к минимуму вклад иммунного инфильтрата или стромального компонента, что особенно важно при молекулярном профилировании РШМ ранних стадий, где доля собственно опухолевых клеток может быть относительно невелика; эта возможность, например, была использована в работе Santin и соавт., где с помощью микрочиповой технологии сравнивался транскриптом нормальных цервикальных кератиноцитов, переведенных во временную культуру, и опухолевых клеток ВПЧ16+/18+ РШМ ранних стадий, культивируемых аналогичным способом (Santin, 2005). Еще одно достоинство временных культур первичных клеток, полученных непосредственно от пациенток с РШМ, по сравнению с долгосрочными клеточными линиями РШМ, заключается в том, что при длительном культивировании клеток РШМ может происходить селекция определенных клонов и закрепление какого-либо одного молекулярного фенотипа, что тем самым отдаляет фенотип полученной постоянной культуры от исходного фенотипа первичной опухоли (Santin, 2005; Magaldi, 2012), в то время как временная первичная культура поддерживает исходный фенотип. Наконец, извлечение клеток из первичной опухоли предоставляет возможность изучения т.н. опухоль-ассоциированных фибробластов (tumor-associated fibroblasts, TAFs), интерес к которым в настоящее время все больше возрастает в связи с пониманием их важной роли в прогрессии опухоли. Например, Walch-Ruckheim и соавт., используя в своем исследовании культуру фибробластов, полученных из биопсийных образцов РШМ, показали, что опухолевые клетки РШМ посредством IL-6 «инструктируют» фибробласты, чтобы они продуцировали хемокин CCL20, с помощью которого осуществляется рекрутирование Th17-лимфоцитов и тем самым создание провоспалительного микроокружения (Walch-Ruckheim, 2015). Таким образом, уникальный спектр возможностей, предоставляемый временными культурами клеток ЦИН/РШМ для проведения фундаментальных и прикладных исследований, а также разработки методов индивидуальной диагностики и терапии, подтверждает необходимость дальнейшей наработки опыта по получению таких культур и манипуляциям с ними, и дополнительного изучения влияния условий культивирования на фенотипические свойства этих клеток.
Благодарности
Работа поддержана грантом РФФИ, проект № 16-34-60019.
Библиография
1. Bononi I, Bosi S, Bonaccorsi G, Marci R, Patella A, Ferretti S, Tognon M, Garutti P, Martini F. Establishment of keratinocyte colonies from small-sized cervical intraepithelial neoplasia specimens. J Cell Physiol 2012; 227(12):3787-3795. DOI: 10.1002/jcp.24088.
2. Fan T, Li X, Li Y, Zhi Y, Rong S, Cheng G, Zhang X. An improved method for primary culture of normal cervical epithelial cells and establishment of cell model in vitro with HPV-16 E6 gene by lentivirus. J Cell Physiol 2017. DOI: 10.1002/jcp.25978.
3. Ikeda K, Tate G, Suzuki T, Mitsuya T. Coordinate expression of cytokeratin 8 and cytokeratin 17 immunohistochemical staining in cervical intraepithelial neoplasia and cervical squamous cell carcinoma: an immunohistochemical analysis and review of the literature. Gynecol Oncol 2008; 108(3):598-602. DOI: 10.1016/j.ygyno.2007.11.042.
4. Koopman LA, Szuhai K, van Eendenburg JD, Bezrookove V, Kenter GG, Schuuring E, Tanke H, Fleuren GJ. Recurrent integration of human papillomaviruses 16, 45, and 67 near translocation breakpoints in new cervical cancer cell lines. Cancer Res 1999; 59(21):5615-5624.
5. Lee H, Lee H, Cho YK. Cytokeratin7 and cytokeratin19 expression in high grade cervical intraepithelial neoplasm and squamous cell carcinoma and their possible association in cervical carcinogenesis. Diagn Pathol 2017; 12(1):40. DOI: 10.1186/s13000-017-0632-5.
6. Liu YZ, Lü XP, Pan ZX, Zhang W, Chen ZR, Wang H, Liu H, Zhang YZ. Establishment of a novel method for primary culture of normal human cervical keratinocytes. Chin Med J (Engl) 2013; 126(17):3344-3347.
7. Liu YZ, Wang TT, Zhang YZ. A modified method for the culture of naturally HPV-infected high-grade cervical intraepithelial neoplasia keratinocytes from human neoplastic cervical biopsies. Oncol Lett 2016; 11(2):1457-1462. DOI: 10.3892/ol.2016.4096.
8. Magaldi TG, Almstead LL, Bellone S, Prevatt EG, Santin AD, DiMaio D. Primary human cervical carcinoma cells require human papillomavirus E6 and E7 expression for ongoing proliferation. Virology 2012; 422(1):114-124. DOI: 10.1016/j.virol.2011.10.012.
9. Mills AM, Paquette C, Terzic T, Castle PE, Stoler MH. CK7 Immunohistochemistry as a Predictor of CIN1 Progression: A Retrospective Study of Patients From the Quadrivalent HPV Vaccine Trials. Am J Surg Pathol 2017; 41(2):143-152. DOI: 10.1097/PAS.0000000000000747.
10. Santin AD, Zhan F, Bignotti E, Siegel ER, Cané S, Bellone S, Palmieri M, Anfossi S, Thomas M, Burnett A, Kay HH, Roman JJ, O'Brien TJ, Tian E, Cannon MJ, Shaughnessy J Jr, Pecorelli S. Gene expression profiles of primary HPV16- and HPV18-infected early stage cervical cancers and normal cervical epithelium: identification of novel candidate molecular markers for cervical cancer diagnosis and therapy. Virology 2005; 331(2):269-291. DOI: 10.1016/j.virol.2004.09.045.
11. Stanley MA. Culture of human cervical epithelial cells. In: Freshney RI, Freshney MG, eds. Culture of epithelial cells, 2nd ed. New York: Wiley-Liss; 2002: 137-169.
12. Sullivan BT, Cherry JA, Sakamoto H, Henkes LE, Townson DH, Rueda BR. Cytokeratin 18 expression inhibits cytokine-induced death of cervical cancer cells. Int J Gynecol Cancer 2010; 20(9):1474-1481. DOI: 10.1111/IGC.0b013e3181fc3a03.
13. Walch-Rückheim B, Mavrova R, Henning M, Vicinus B, Kim YJ, Bohle RM, Juhasz-Böss I, Solomayer EF, Smola S. Stromal Fibroblasts Induce CCL20 through IL6/C/EBPβ to Support the Recruitment of Th17 Cells during Cervical Cancer Progression. Cancer Res 2015; 75(24):5248-5259. DOI: 10.1158/0008-5472.CAN-15-0732.