Введение
Крапивница представляет собой гетерогенное, широко распространенное заболевание, характеризующееся развитием волдырей (urtica) и/или ангиоотеков, в основе которого лежат как иммунные, так и неиммунные механизмы развития (Горячкина, 2009; Zuberbier, 2014). Каждый четвёртый хотя бы однократно в жизни имел эпизод крапивницы, а хронической формой страдают до 2/5% европейцев (например, в Дании) (Горячкина, 2009).
Острая крапивница протекает до 6 недель. Хронизация крапивницы приводит к существенному снижению качества жизни пациентов, сравнимого с таковым у страдающих тяжелыми сердечно-сосудистыми заболеваниями (Горячкина, 2009). Как хроническая, так и острая крапивница зачастую становятся причиной регулярной нетрудоспособности, приводящей к значительным экономическим потерям.
Роль цитокинового профиля пациентов с нарушениями иммунной системы особо значима. Цитокины участвуют в регуляции организма наравне с такими регуляторными системами, как эндокринная и нервная (Щеглова, 2005). Экспрессия цитокинов индуцируется как внешними экзогенными факторами (биологическими, физическими, химическими), так и эндогенными. Цитокины, выступая в роли медиаторов иммунной системы, связываются с высокоафинными рецепторами на поверхности клеток-мишеней, проявляют свое действие в микроконцентрациях (10-15М). Вступая в реакции взаимодействия между собой, цитокины оказывают как синергическое (потенцирующее), так и антагонистическое действие друг на друга в зависимости от условий реакции. Каскадность цитокиновых реакций и образование так называемых «цитокиновых сетей» обуславливает их многообразие и повсеместное участие в регуляции (Щеглова, 2005).
Исследование цитокинового профиля пациентов, страдающих крапивницей, является определяющим в понимании механизмов развития различных форм крапивницы. В то время, как патогенез хронических форм крапивницы, где преобладают аутоиммунные и не-IgE-опосредованные механизмы, достаточно хорошо освещен в современной литературе (Синельникова, 2017; Degirmenci, 2017; Maurer, 2016; Zuberbier, 2014), патогенез острой крапивницы представляет для исследователей меньший интерес. Однако вопрос является актуальным, учитывая «эпидемию» крапивницы в современном мире и нередкую хронизацию этого заболевания. Более ранние литературные источники свидетельствовали о преобладании IgE-опосредованных аллергических реакций в развитии острых форм крапивницы, например, на пенициллины, орехи, латекс, некоторые эпидермальные аллергены (Горячкина, 2009). Накопленные знания об участии цитокинов в иммунопатогенезе позволяют нам предположить более широкое разнообразие патогенетических механизмов острой крапивницы, как IgE-опосредованные, так и IgE-неопосредованные.
Как известно, в основе патогенеза IgE-опосредованных реакций лежит дисбаланс Т-хелперных лимфоцитов Th1- и Th2-типа в сторону преобладания последних, при этом решающую роль играет дисбаланс продуцируемых этими популяциями клеток цитокинов (Бережная, 2010). В индукции начальных этапов многих IgE-опосредованных реакций принимают участие IL-25, IL-33, TSLP (тимус-стромальный лимфопоэтин), цитокин, образующийся в эпителиальных клетках бронхов, легких, кишечника, кожи, а также в тучных клетках (Licona-Limón, 2013; Paul, 2010; Roediger, 2015). Доказана роль TSLP в инициации Th2-ответа при аллергической бронхиальной астме, некоторых противогельминтных реакциях (Oliphant, 2011; Roediger, 2015). TSLP принимает участие в активации дендритных клеток, выделении ими хемокинов, стимулирующих миграцию Th2-лимфоцитов и инициирующих дифференцировку наивных Т-лимфоцитов (CD4+CD8+) в эффекторные клетки с аллергическим фенотипом (Oliphant, 2011). Активация и стимуляция Th2 приводит к усилению продукции IL-4, IL-5, IL-9, IL-13 – цитокинов, ответственных за регуляцию синтеза IgE и продукцию хемокинов (Бережная, 2010; Licona-Limón, 2013; Oliphant, 2011; Sahoo, 2016).
IL-4 играет центральную роль в дифференцировке и пролиферации антигенстимулированных наивных Т-клеток в Th2, являясь регулятором аллергического воспаления, а также подавляет развитие Th1-клеток и направляет переключение биосинтеза тяжелой цепи иммуноглобулина на IgE и IgG4 (Degirmenci, 2017; Paul, 2010). IL-4 стимулирует рост тучных клеток, индуцирует экспрессию высокоафинного рецептора IgE (FcεRI) на В-лимфоцитах человека. При связывании IgE с высокоафинными рецепторами FcεRI тучных клеток происходит их дегрануляция с высвобождением гистамина, гепарина, протеаз, образованием лейкотриенов, простогландинов, цитокинов, таких как TNFα и IL-1 (Сергеев, 2001; Atwa, 2014). Выброс биологически активных веществ вследствие дегрануляции способствует сокращению гладкой мускулатуры, повреждению сосудов, повышению их проницаемости, в результате чего развивается зуд и отек тканей (Paul, 2010).
Целью настоящей работы явилось определение общего IgE, IL-4, TNFα у пациентов с острой крапивницей; определение роли этих цитокинов в патогенезе острой крапивницы.
Материалы и методы
Исследуемая группа состояла из 50 пациентов, госпитализированных в больницу скорой медицинской помощи г. Петрозаводска в связи с клинической картиной острой крапивницы, либо крапивницы в сочетании с ангиоотеком. Контрольная группа была представлена 20 здоровыми студентами, не имеющими в анамнезе как хронических соматических, так аллергических заболеваний.
Определение уровня IgE проводилось методом иммуноферментного анализа (ИФА) с использованием тест-системы «Вектор-Бест», уровня IL-4 и TNFα – методом ИФА с использованием тест-систем «Цитокин». Образцы сывороток крови замораживали без добавления консервантов сразу после забора материала и хранили при температуре -40°С.
Статистическая обработка полученных данных проводилась с использованием компьютерной программы STATISTICA 6.0 (StatSoft, США). Для сравнения полученных данных использован непараметрический критерий Манна-Уитни (Mann-Whitney U-test). Уровень критерия считался статистически значимым при р˂0.05. Корреляционный анализ проведен с помощью ранговой корреляции Спирмена.
Результаты
Пациенты исследуемой группы были госпитализированы с острой крапивницей, либо сочетанием крапивницы и ангиоотека. Уровень общего IgE был повышен (более 75 МЕ/мл) у 55.1% пациентов. У 22.4% пациентов имело место значительное превышение нормы, уровень общего IgE в сыворотке крови составил более 500 МЕ/мл. Среднее значение уровня общего IgE в сыворотке крови пациентов составило 500.4±933.5 МЕ/мл (min 0; max 3319,1). У 89.5% контрольной группы уровень общего IgE имеет нормальное значение, тогда как у остальных 10.5% превышение нормы было незначительным (не более чем в 2 раза). В группе контроля параметры среднего значения уровней общего IgE находились в пределах 27.0±49.5 МЕ/мл (min 0; max 193.6). Таким образом, уровень общего IgE оказался достоверно повышенным у пациентов с острой крапивницей/ангиоотеком (р=0.000088, Uэмп.=178) (Рисунок 1).
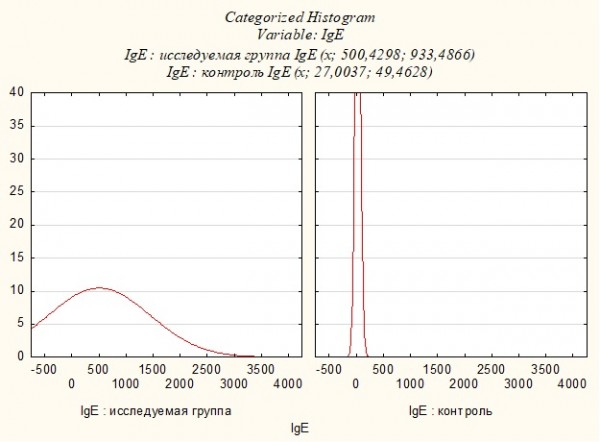
Рисунок 1. Уровень общего IgE в исследуемой группе и группе контроля.
Figure 1. The level of total IgE in the study group and the control group.
Анализ цитокинового профиля больных и контрольной групп показал, что средний уровень IL-4 в исследуемой группе составил 16.99±28.44 пг/мл (min 6.4; max 200.0), средний уровень IL-4 в контрольной группе составил 4.34±4.21 пг/мл (min 0.43; max 14.91), что свидетельствовало о достоверно повышенном уровне IL-4 у пациентов (р˂0.001, Uэмп.=90.5) (Рисунок 2).
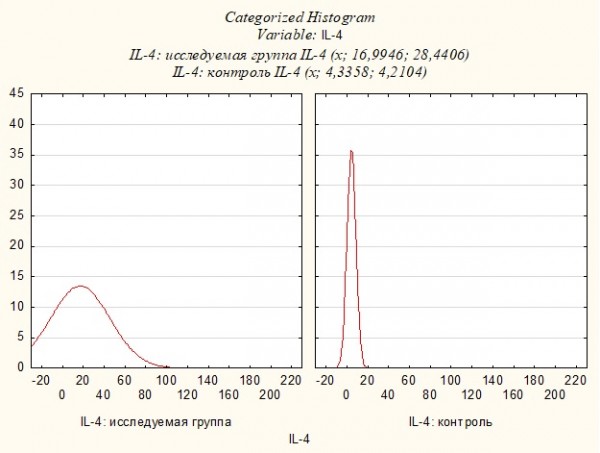
Рисунок 2. Уровень IL-4 в исследуемой группе и группе контроля.
Figure 2. Level of IL-4 in the study group and control group.
Средний уровень TNFα больных достигал 3.39±4.03 пг/мл (min 0.27; max 20.66), тогда как у здоровых он оказался 2.09±3.2 пг/мл (min 0.36; max 12.33), что говорило о достоверно повышенной концентрации TNFα у носителей патологии (р= 0.004571, Uэмп.=245.5) (Рисунок 3).
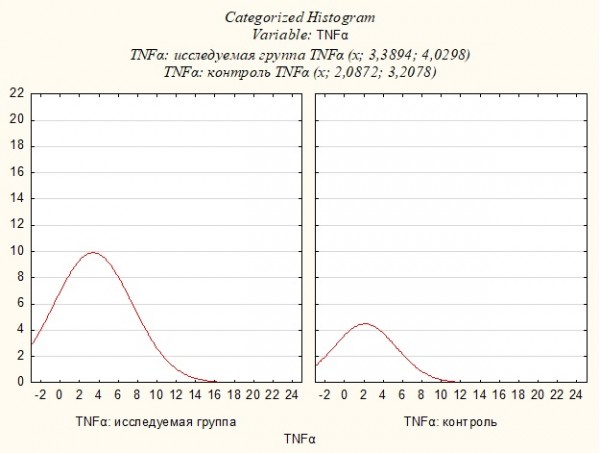
Рисунок 3. Уровень TNFα в исследуемой группе и группе контроля.
Figure 3. The level of TNFα in the study group and in the control group.
Проведенный корреляционный анализ показывает, что высокий уровень TNFα значимо коррелирует с повышенным уровнем общего IgE в сыворотке пациентов исследуемой группы (R=0.39, р=0.0058). Несмотря на то, что уровень IL-4 в исследуемой группе значительно превышал уровень IL-4 в контрольной группе, проведенный анализ не выявил достоверной корреляционной связи между уровнем IL-4 и уровнем общего IgE в сыворотке пациентов исследуемой группы (R=0.15, р=0.32).
Выводы
- Выявленное диагностически значимое повышение уровня общего IgE у 22.4% пациентов с острой крапивницей свидетельствует о том, что почти у четверти пациентов острая крапивница является аллергической, IgE-опосредованной.
- Высокий уровень IL-4 у пациентов отражает тот факт, что иммунный ответ при острой крапивнице развивается преимущественно по Th2-типу. Однако отсутствие достоверной корреляционной связи между уровнем IL-4 и уровнем общего IgE может стать косвенным признаком того, что в патогенезе острых форм крапивницы нередко задействован аутоиммунный ответ, который преимущественно развивается так же по Th2-типу и наиболее характерен для хронических форм крапивницы (спонтанной) (Синельникова, 2017).
- Мы показали, что у больных с острой крапивницей имеет место повышение уровня TNFα, что отражает участие данного цитокина в патогенезе острых форм крапивницы, имеющих различные механизмы развития. Выявленная достоверная корреляционная связь между уровнем TNFα и уровнем общего IgE гипотетически может свидетельствовать о том, что TNFα является не только продуктом дегрануляции тучных клеток, но и участвует на одном из этапов инициации IgE-опосредованного ответа.
Библиография
1. Atwa MA, Emara AS, Youssef N, Bayoumy NM. Serum concentration of IL-17, IL-23 and TNF-α among patients with chronic spontaneousurticaria: association with disease activity and autologous serum skin test. J Eur Acad Dermatol Venereol 2014, 28(4):469-474.
2. Degirmenci PB, Kırmaz C, Vatansever S, Onur E, Nal E, Erdin S, Ozyurt B. Analysis of the association of chronic spontaneous urticaria with interlekin-4, -10, transforming growth factor-β1, interferon-γ, interleukin-17A and -23 by autologous serum skin test. Postepy Dermatol Alergol 2017, 34(1):70-76.
3. Licona-Limón P, Kim LK, Palm NW, Flavell RA. TH2, allergy and group 2 innate lymphoid cells. Nat Immunol 2013, 14(6):536-542.
4. Maurer M. Chronic urticaria: The evolution of etiopathogenic concepts. Abstract book. 3rd GA2LEN Global Urticaria Forum, 2016:12.
5. Oliphant CJ, Barlow JL, McKenzie AN. Insights into the initiation of type 2 immune responses. Immunology 2011, 134(4):378-385.
6. Paul WE, Zhu J. How are T(H)2-type immune responses initiated and amplified? Nat Rev Immunol 2010, 10(4):225-235.
7. Roediger B, Weninger W. Group 2 innate lymphoid cells in the regulation of immune responses. Adv Immunol 2015, 125:111-154.
8. Sahoo A, Wali S, Nurieva R. T helper 2 and T follicular helper cells: Regulation and function of interleukin-4. Cytokine Growth Factor Rev 2016, 30:29-37.
9. Zuberbier T, Aberer W, Asero R, Bindslev-Jensen C, Brzoza Z, Canonica GW, Church MK, Ensina LF, Giménez-Arnau A, Godse K, Gonçalo M, Grattan C, Hebert J, Hide M, Kaplan A, Kapp A, Abdul Latiff AH, Mathelier-Fusade P, Metz M, Nast A, Saini SS, Sánchez-Borges M, Schmid-Grendelmeier P, Simons FE, Staubach P, Sussman G, Toubi E, Vena GA, Wedi B, Zhu XJ, Maurer M; European Academy of Allergy and Clinical Immunology; Global Allergy and Asthma European Network; European Dermatology Forum; World Allergy Organization. The EAACI/GA(2) LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy 2014, 69(7):868-887.
10. Бережная Н.М. Интерлейкин 25 (IL-17E): виновник аллергии и противник рака // Цитокины и воспаление. – 2010. – Т.9. – №3. – С.3–14.
11. Горячкина Л.А., Борзова Е.Ю. Крапивница и ангиоотек Квинке. Клиническая аллергология и иммунология. Руководство для практикующих врачей. М.: Миклош, 2009. С.222–271.
12. Сергеев Ю.В., Новиков Д.К., Караулов А.В., Сергеев А.Ю. Атопический дерматит: гетерогенность клинических форм и разнообразие механизмов патогенеза // Иммунопатология, аллергология, инфектология. – 2001. – №3. – С.61–73.
13. Синельникова Н.А., Калинина Н.М., Савенкова Н.Д. Представления об иммунопатогенезе хронической крапивницы у детей // Российский аллергологический журнал. – 2017. – №1. – С.139–141.
14. Щеглова М.Ю. Система цитокинов в норме и при болезнях органов дыхания // Бюллетень физиологии и патологии дыхания. – 2005. – №21. – С.93–97.