Введение
Канцерогенез опухолей эпителиального происхождения – сложный многоэтапный процесс, протекающий через последовательную смену предраковых состояний, интраэпителиального (карциномы in situ) и микроинвазивного рака, и сопровождающийся согласованным переключением активности различных групп генов. Как правило, начальные (преинвазивные) этапы развития опухоли персистируют в течение длительного времени благодаря естественным механизмам контроля, однако, в случае формирования инвазивного фенотипа наблюдается быстрая прогрессия и метастазирование. Именно поэтому одной из наиболее актуальных задач является изучение пусковых факторов и молекулярных механизмов индукции инвазивного роста при естественном развитии опухоли в организме человека. В исследованиях последних лет, из всех ключевых свойств опухолевой клетки, определяющих возможность неконтролируемого роста и диссеминации, особое внимание уделяется способности стимулировать ангиогенез/лимфангиогенез и эпителиально-мезенхимальному переходу. Накопленные сведения позволяют предполагать, что для опухолевых клеток эпителиальной принадлежности активация этих двух взаимосвязанных процессов (лимфангиогенеза, ЛА, и эпителиально-мезенхимального перехода, ЭМП) является наиболее специфичным показателем злокачественной трансформации. Так называемое «лимфангиогенное переключение», ассоциированное с ЭМП, является, по-видимому, первым сигналом о предрасположенности клеток к инвазии (выходу за пределы эпителиального слоя) и последующему метастазированию (Paduch, 2016).
Молекулярные механизмы регуляции опухолевого ЛА и ЭМП очень сложны и по-прежнему дискуссионны. В настоящее время активно исследуются сигнальные каскады и функции генов, обеспечивающие изменение клеточной морфологии и формирование про-ангиогенного фенотипа, однако, подавляющее большинство таких исследований проводится с использованием различных экспериментальных систем, основанных на стандартных опухолевых клеточных линиях или модельных животных. Несмотря на высокую значимость полученных с их помощью сведений, in vitro системы и in vivo модели не позволяют установить естественную динамику экспрессии ЭМП- и ЛА-ассоциированных генов и регуляторные взаимосвязи между ними на всем протяжении развития опухоли, начиная с доброкачественных изменений. Поэтому реконструкция молекулярных механизмов ЭМП/ЛА и профилей генной активности в сопоставлении с ранними этапами естественного развития опухоли эпителиального происхождения (карциномы), включая предраковые изменения, истинный преинвазивный и микроинвазивный рак, представляет актуальную задачу. Основным затруднением для ее решения является то, что для многих типов рака такие ранние стадии очень трудно диагностировать. Современные методы позволяют проводить полногеномный анализ молекулярного профиля опухолей, полученных от пациентов, однако, в большинстве случаев по-прежнему исследователи имеют дело с более поздними стадиями инвазивного рака, что затрудняет исследование экспрессии генов при переходе от интраэпителиальной неоплазии к инвазивному росту. С этой точки зрения, процесс естественного развития ВПЧ-ассоциированного плоскоклеточного рака шейки матки (РШМ) – через цервикальные интраэпителиальные неоплазии 1, 2, 3 степени (ЦИН1/2/3), рак in situ (РШМ «0 стадии») и микроинвазивный рак (РШМ IA1 стадии) – представляет собой уникальную in vivo модель для изучения процессов канцерогенеза и, в том числе, механизмов регуляции ЛА и ЭМП. Для РШМ на основе морфологических критериев достаточно подробно описаны и клинически легко выявляются все перечисленные этапы развития. ЦИН1/2 в подавляющем большинстве случаев спонтанно регрессирует, однако, часть из них после длительной персистенции переходит в ЦИН3 (рак in situ). Переход ЦИН2/ЦИН3 связывают с комплексом молекулярно-генетических нарушений, приводящих к злокачественной трансформации эпителиальных клеток. Ввиду вирусной этиологии, формирование пролимфоангиогенного фенотипа («лимфангиогенное переключение») и индукция ЭМП могут являться очень ранним событием в развитии РШМ, что еще раз подчеркивает необходимость анализа наиболее ранних стадий развития неоплазии при расшифровке пусковых механизмов инвазии и метастазирования. Цель проведенного исследования состояла в анализе профилей экспрессии ЛА-/ЭМП-ассоциированных генов, характерных для нормального цервикального эпителия, ЦИН 1-3 степени (включая рак in situ) и микроинвазивного РШМ.
Материалы и методы
Пациенты. Образцы ткани (нормального и патологического эпителия шейки матки) были получены от пациенток, проходящих лечение в ГБУЗ «Республиканский онкологический диспансер» Республики Карелия и Женской консультации №1 г. Петрозаводска, давших добровольное согласие на участие в исследовании. Дизайн исследований одобрен Комитетом по медицинской этике ПетрГУ и Министерством здравоохранения Республики Карелия. Были проанализированы образцы морфологически нормального эпителия ВПЧ(-/+), фоновых изменений, ЦИН 1-3 степени, включая преинвазивный /интраэпителиальный рак (карцинома in situ, или РШМ «0» стадии), и микроинвазивного РШМ (стадия IA1, микрокарцинома). Постановка и верификация клинического диагноза проводилась в соответствии со всеми отраслевыми стандартами. Для стабилизации РНК в образцах использовали IntactRNA («Евроген», Москва).
Количественная ПЦР (qPCR). После гомогенизации образца тотальную РНК выделяли путем фенольной экстракции (TRizol, «Invitrogen»); нативность РНК проверяли методом капиллярного электрофореза с помощью автоматизированной системы Fragment Analyzer(«Advanced Analytical», США); концентрацию и чистоту препарата РНК (А260/А280) определяли спектрофотометрически. кДНК синтезировали на тотРНК (1 мкг РНК – 1V), обработанной ДНКазой I («Fermentas», ThermoScientific), с использованием набора ProtoScript II (New England BioLabs). Анализ относительного уровня экспрессии генов проводили с помощью термоциклера StepOnePlus («Applied Biosystems») c использованием SYBR Green в качестве репортерного красителя (ROX – в качестве референсного красителя) и ген-специфических праймеров. Реакционные смеси для ПЦР («qPCRmix-HS-SYBR+HighROX») и олигонуклеотиды были получены от компании «Евроген» (Москва). Для нормализации уровня активности таргетных генов в качестве референсных использовали сочетание генов, характеризующихся относительно постоянным уровнем экспрессии в клетках цервикального эпителия независимо от наличия патологического процесса, степени дисплазии или стадии РШМ: EEF1A1, ACTB, GAPDH, RPLP0 (Leitao, 2014) и Alu-последовательности (Rihani, 2014). Относительное содержание мРНК исследуемых генов в образцах анализировали по методу 2^(-dCt) с учетом различий в параметре эффективности амплификации (Е, %), которую определяли методом кривых разведения кДНК-матрицы для каждой пары праймеров (Pfaffl, 2006). Расчет нормализующего коэффициента на основе нескольких генов с доказанной конститутивной экспрессией проводился в соответствии с алгоритмом gеNorm (www.qbaseplus.com) и учетом параметра эффективности. Специфичность отжига праймеров контролировали с помощью кривых плавления ПЦР-продуктов в каждом эксперименте, а также методом гель-электрофореза (с визуализацией в автоматической системе GelDoc-It M-26XV («UVP»)).
Вестерн-блоттинг. Образцы нормального эпителия, ЦИН1 (ВПЧ+), ЦИН2-3, интраэпителиального и микроинвазивного РШМ гомогенизировали в RIPA-буфере (с добавлением ингибиторов протеиназ Halt Protease Inhibitor Cocktail 100X), концентрацию общего белка в лизатах определяли с помощью Pierce BCA Protein Assay kit («Thermo Scientific»). После разделения в денатурирующем 8-16% диск-электрофорезе по системе Лэммли белки переносили на нитроцеллюлозную мембрану, которую блокировали в течение 1 ч в присутствии 5% обезжиренного молока и далее инкубировали в течение ночи при +4 °С с соответствующими первичными и, в течение 1 ч, вторичными антителами (кроличьи pAb против VEGF-C и VEGFR3/FLT4 человека, анти-кроличьи IgG-HRPO, «Abcam») с последующей хемилюминесцентной детекцией (Pierce ECL Plus, Thermo Scientific). В качестве позитивного контроля использовали клеточную линию аденокарциномы шейки матки (HeLa Whole Cell лизат, «Abcam»), для контроля нанесения (25 мкг) использовали моноклональные антитела к бета-актину (Loading Control, «Abcam») и вторичные анти-мышиные IgG-HRPO («Bio-Rad»).
Результаты и обсуждение
Для всех указанных выше этапов развития инвазивного РШМ методом qPCR был проведен анализ экспрессии спектра генов, контролирующих ключевые точки сигнальных путей ЛА и ЭМП, а именно специфические факторы роста (VEGF-С и -D, HGF, PlGF), их рецепторы (VEGFR3/FLT4, c-Met/HGFR), транскрипционные факторы – мастер-регуляторы лимфоэндотелиальной дифференцировки (Prox1, ETS) и мезенхимального фенотипа (Slug/Snai2, FOXC2), а также факторы множественной лекарственной устойчивости, ассоциированные с ЭМП (MRP1/ABCC1, BCRP/ABCG2). Описаны стадий-специфичные паттерны активности генов, принадлежащих разным функциональным группам (Рисунок 1, 2), выявлены межгенные взаимосвязи, подтверждающие раннюю активацию и кросс-регуляцию соответствующих сигнальных путей in vivo. Были охарактеризованы различные профили изменений экспрессии индивидуальных генов: а) градуальные изменения по мере увеличения степени тяжести патологии, б) де-регуляция при любых нарушениях вне зависимости от их степени тяжести, в) изменения, ассоциированные с переходом между интраэпителиальными неоплазиями и ранним инвазивным раком. В частности, наблюдалось достоверное увеличение экспрессии фактора VEGF (vascular endothelial growth factor) -C, ключевого индуктора лимфоангиогенеза (Wang, 2015), опосредующего взаимосвязь данного процесса с ЭПМ, в образцах ЦИН3/РШМ «0» стадии; в то же время только в единичных образцах ВПЧ(+) эпителия или ЦИН1 экспрессия VEGF-C была повышена относительно ВПЧ(-) нормального эпителия; средние групповые значения относительного уровня мРНК VEGF-C характеризуются монотонным увеличением по мере прогрессии степени тяжести патологии. В отличие от VEGF-C, для другого критически важного регулятора постнатального (в том числе, опухолевого) лимфоангиогенеза и инвазии – VEGF-D (Wang, 2016) – не обнаружено достоверных изменений среднегрупповых значений, однако, до 50% образцов каждой стадии развития патологии имели повышенный уровень VEGF-D мРНК. Профиль изменения экспрессии малоисследованного представителя VEGF-семейства – плацентарного фактора роста (PlGF, placenta growth factor), координирующего процессы ангиогенеза, ЭМП и воспаления (Dewerchin, 2012), схож с VEGF-C (с более выраженным увеличением при истинном интраэпителиальном раке).
Для гепатоцитарного фактора роста (HGF, hepatocyte growth factor), не принадлежащего VEGF-семейству, с такой же, как у VEGF-C, выраженной способностью стимулировать перитуморальный ЛА (Cao, 2006), но выполняющего независимую от VEGF-C функцию (Gibot, 2016), зафиксировано значимое повышение экспрессии на микроинвазивном этапе развития РШМ (Рисунок 1). Экспрессия ключевого лимфоэндотелий-специфичного рецептора VEGFR3, активируемого как VEGF-C, так и VEGF-D, претерпевает изменения, аналогичные VEGF-C. В этой связи интересны результаты по профилю экспрессии другой рецепторной тирозинкиназы HGFR/cMET: в отличие от VEGFR3, для HGFR выявлено существенное повышение относительного уровня мРНК на этапе предрака (ЦИН1-2). Это подкрепляет представления о более широком спектре активности протоонкогена cMET: кроме стимуляции ЛА, он выступает ведущим регулятором ЭМП, а также стимулятором клеточной пролиферации, которая является основным признаком ВПЧ-индуцированной гиперплазии цервикального эпителия, однако, полученные на текущем этапе данные не позволяют говорить о прямой корреляции экспрессии HGFR со степенью тяжести патологического процесса. В отличие от рассмотренных генов, в отношении тромбоспондина-1 (TSP1) – компонента межклеточного матрикса, выполняющего функции регулятора (как позитивного, так и негативного) ангиогенеза, ЭПМ и инвазии (Jeanne, 2015) – достоверные отклонения уровня экспрессии от нормы не прослеживаются.
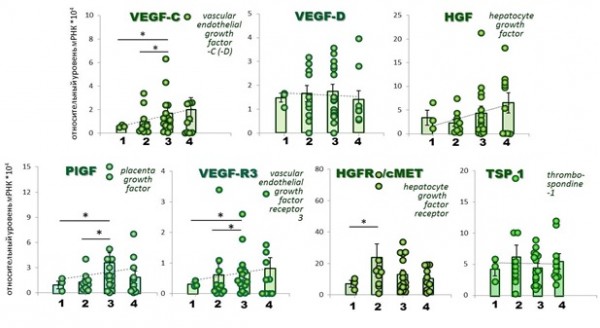
Рисунок 1. Изменение относительного уровня экспрессии генов, ассоциированных с ЛА и ЭПМ, на ранних этапах развития РШМ. Столбчатые диаграммы соответствуют значениям M±m для каждой анализируемой группы (контроль/патология). Группы: 1 – ВПЧ-отрицательный морфологически нормальный эпителий (контроль), 2 – ВПЧ(+) фоновые нарушения и ЦИН 1 степени, 3 – ЦИН 2-3 степени (включая рак in situ), 4 – РШМ IA1 стадии (микрокарцинома). * p
Figure 1. Dotplots showing the change of relative expression levels of genes associated with LA and EMT at early stages of cervical cancer development. Columns on overlaid histograms correspond to M±m values for each group analyzed (controls vs. pathology). Groups (X axis): 1 – HPV-negative morphologically normal epithelium (control), 2 – HPV(+) benign lesions and CIN1, 3 – CIN2-3 (including cancer in situ), 4 – stage IA1 of cervical cancer (microcarcinona). * p
Прогрессия цервикальных неоплазий в инвазивный рак, согласно проведенному анализу, сопровождается также увеличением количества мРНК транскрипционного фактора Prox1 (Prospero homeobox 1), который представляет точку схождения различных сигнальных путей ЛА (Yu, 2014); необходимо отметить, что в значительной доле образцов преинвазивного и микроинвазивного РШМ мРНК-Prox1 не выявлялась (в то время как в других образцах ее содержание было резко повышено), что, очевидно, обусловлено высокой тканевой специфичностью экспрессии этого фактора и клеточной гетерогенностью опухоли, формируемой на начальных этапах ее развития (Рисунок 2). Транскрипционный фактор ETS1 (E26-transformation specific) обеспечивает взаимосвязь между процессами лимфоангиогенеза и гемангиогенеза через непосредственное взаимодействие с Prox1 (Yoshimatsu, 2011); согласно нашим данным, увеличение его экспрессии преимущественно ассоциировано с ЦИН3/раком in situ. Связующим звеном между сигнальными механизмами лимфоангиогенеза и ЭМП является мезенхимальный транскрипционный фактор FoxC2, контролирующий, с одной стороны, дифференцировку лимфоэндотелия (Wu, 2011), и, с другой стороны, выполняющий функцию медиатора ЭПМ (Cai, 2015); интересно, что в нашем исследовании профиль изменения экспрессии FoxC2 при развитии РШМ (с более выраженной активацией на этапе ЦИН1-2) оказался схожим с cMET/HGFR, что согласуется с новыми сведениями о cMET как прямой FoxC2-мишени при канцерогенезе (Cui, 2015). Другой проанализированный нами компонент этой регуляторной сети – транскрипционный фактор Slug (Snai-семейство), являющийся собственно индуктором ЭПМ, – демонстрировал наиболее выраженное усиление экспрессии при ЦИН3/РШМ «0», то есть на этапе формирования истинного рака, предшествующем активации инвазии. Важнейшим следствием процесса ЭПМ является приобретение естественной («de novo», не индуцированной ксенобиотиками) множественной лекарственной устойчивости (МЛУ), обусловленной, в том числе, активацией экспрессии АВС-транспортеров (ATP-binding cassette) под действием FoxC2 и Snai-транскрипционных факторов (Sui, 2014). Интересно, что для представителей АВС-семейства MRP1 (ABCC1) и BCRP (breast cancer resistance protein, ABCG2), как показывают полученные результаты, характерны различные профили изменения экспрессии по мере развития РШМ (Рисунок 2). Активация экспрессии гена BCRP1 наблюдалась в образцах раннего РШМ (стадия «0»-IA), но не предрака или фоновых нарушений; наоборот, для MRP1 (multidrug resistance-associated protein 1), экспрессируемого в норме эпителиальными тканями, наибольшая степень увеличения количества мРНК была выявлена в образцах ЦИН1, а не истинного рака; отсутствие корреляции (r= -0.11) между ними говорит о возможной независимой регуляции экспрессии MRP1 и BCRP при канцерогенезе РШМ.
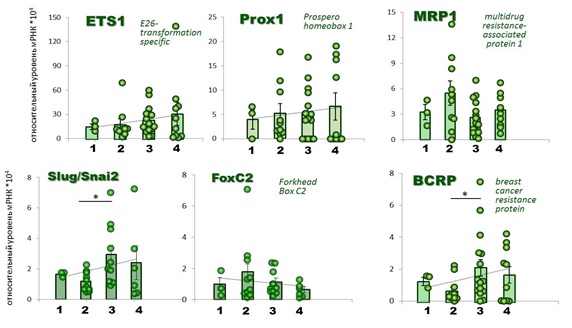
Рисунок 2. Изменение относительного уровня экспрессии транскрипционных факторов, ассоциированных с ЛА и ЭМП, и факторов множественной лекарственной устойчивости на ранних этапах развития РШМ. Столбчатые диаграммы соответствуют значениям M±m для каждой анализируемой группы (контроль/патология). Группы: 1 – ВПЧ-отрицательный морфологически нормальный эпителий (контроль), 2 – ВПЧ(+) фоновые нарушения и ЦИН 1 степени, 3 – ЦИН 2-3 степени (включая рак in situ), 4 – РШМ IA1 стадии (микрокарцинома). * p
Figure 2. Dotplots showing the change of relative expression levels of transcription factors implicated in LA / EMT and multidrug resistance genes at early stages of cervical cancer development. Columns on overlaid histograms correspond to M±m values for each group analyzed (controls vs. pathology). Groups (X axis): 1 – HPV-negative morphologically normal epithelium (control), 2 – HPV(+) benign lesions and CIN1, 3 – CIN2-3 (including cancer in situ), 4 – stage IA1 of cervical cancer (microcarcinona). * p
Описанные выше изменения экспрессии ЛА-факторов (VEGF-C, VEGFR3) распространяются и на белковый уровень, как показывают результаты Вестерн-блоттинга (Рисунок 3): содержание VEGF-C возрастает при микроинвазивной карциноме (стадия IA1), причем наиболее выражено увеличение количества полностью процессированной, зрелой секретируемой формы (21 кДа; полосы 58 и 43 кДа соответствуют непроцессированному и частично процессированному предшественнику (Joukov, 1997)); кроме того, увеличение экспрессии VEGF-C наблюдалось в ряде случаев на этапе преинвазивной карциномы (стадия «0»). Относительное увеличение содержания VEGFR3 было выявлено в образцах как интраэпителиального, так и микроинвазивного рака, что соответствует результатам qPCR; так как используемые анти-VEGFR3 антитела направлены на С-концевую область рецептора, можно говорить о том, что выявляемые полосы с разной молекулярной массой соответствуют процессированной и непроцессированной (включающей N-концевые домены) мембранным формам рецептора (Leppanen, 2013).
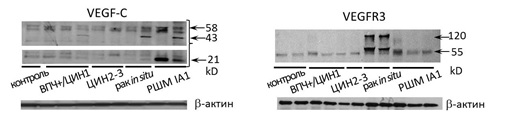
Рисунок 3. Вестерн-блот анализ содержания VEGF-C и VEGFR3 в тканевых лизатах образцов ВПЧ+/ЦИН1-3/микрокарциномы шейки матки и нормального эпителия (приведены результаты 1 из 3 экспериментов)
Figure 3. Western blot of VEGF-C and VEGFR3 in tissue lysates from HPV+/CIN1-3/microcarcinoma of the cervix and normal epithelium (representative results of one of three independent experiments are shown)
Была обнаружена высокая степень корреляции между уровнем экспрессии мРНК VEGF-C и его рецептора (r=0.80), а также между ETS1 и VEGFR3 (r=0.86) на разных этапах развития инвазивного РШМ (Рис. 4); умеренная положительная корреляция зафиксирована для мРНК-уровней ETS1 и VEGF-C (r=0.59), что в совокупности представляет in vivo подтверждение существования «петли» взаимного усиления между генами VEGF-C, VEGFR3 и ETS1 (Gutierrez, 2013). В то же время, уровни экспрессии VEGF-C и -D слабо коррелируют друг с другом (r=0.42) при развитии РШМ, что согласуется с недавними сведениями об их достаточно независимом функционировании в процессе опухоль-ассоциированного лимфоангиогенеза при прогрессии опухолей человека других локализаций (Davydova, 2016). Несмотря на схожесть общего профиля изменений экспрессии VEGF-C и PlGF, корреляции между ними не установлено (r=0.15); аналогичный результат получен для пары ETS1-PlGF (r=0.14). В отличие от PlGF, уровень мРНК HGF показывает высокую взаимосвязь с VEGF-C (r=0.78) (Рисунок 4), подтверждая синергическое действие HGF и VEGF-C в процессах лимфоангиогенеза и ЭМП при прогрессии неоплазии. Уровень экспрессии HGFR/cMET умеренно (r=0.45-0.60) коррелирует с ETS1 (r=0.60) и VEGFR3 (r=0.46), свидетельствуя в пользу их участия в общих регуляторных механизмах, контролирующих неоангиогенез и ЭМП при канцерогенезе РШМ. Для уровня экспрессии Prox1 показана умеренная взаимосвязь с уровнем HGF, однако, между Prox1 и VEGF-C/-D/VEGFR3/ETS1 значимой зависимости не выявлено. Таким образом, по результатам анализа последовательных этапов раннего развития инвазивного РШМ показана специфическая ассоциация между VEGF-C/VEGFR3- и HGF/cMET- сигнальными путями на уровне как ростовых факторов, так и их рецепторов, которая, очевидно, реализуется при участии транскрипционных факторов ETS1 и Prox1.
Описанные результаты по ЛА- и ЭМП-ассоциированным генам были объединены с полученными нами данными по ряду важнейших маркеров пролиферации (протоонкогены c-MYC,c- FOS, Fra-1) и устойчивости к апоптозу (XIAP, c-FLIP, BIRC5/survivin) соответственно выделенным этапам развития РШМ. Полученные таким образом суммарные паттерны степени изменения (в % от нормального уровня) экспрессии генов, принадлежащих разным функциональным группам (Рисунок 5), подтверждают наше предположение о том, что формирование инвазивной карциномы, начиная с наиболее ранних предраковых нарушений, сопровождается закономерными (последовательными) изменениями активности генов-регуляторов лимфоангиогенеза и ЭПМ. На всем протяжении развития инвазивного фенотипа (индукция пролиферации и дедифференцировка → неотрансформация → микроинвазия) может изменяться вклад соответствующих сигнальных механизмов. В частности, как указано на схеме Рисунка 5, для ЦИН1 в большей степени характерен «пролиферативный + антиапоптотический» профиль, поддерживаемый генами пролиферативного ответа c-FOS и Fra-1, а также cMET и VEGFR3; для ЦИН3/РШМ «0» становится более выражен «лимфоангиогенный» профиль, поддерживаемый с участием факторов роста PlGF и VEGF-C; микрокарцинома шейки матки сохраняет выраженный «пролиферативный» профиль, за счет активации c-MYC и Fra-1, и усиливает «лимфоангиогенный+ЭМП» профиль с преобладанием экспрессии VEGF-C-VEGFR3-ETS1 и HGF.
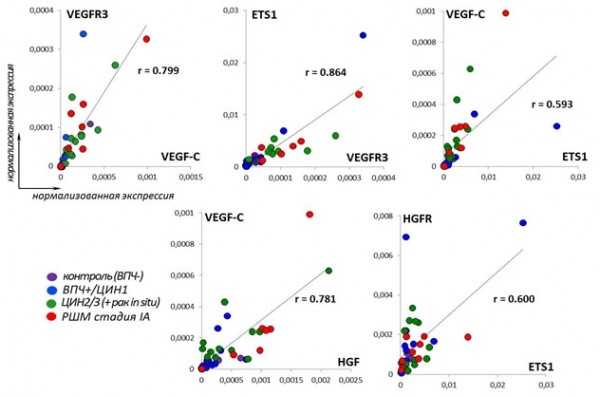
Рисунок 4. Парные корреляции между уровнями экспрессии мРНК генов, вовлеченных в регуляцию ЛА и ЭМП, на разных этапах развития РШМ и в норме.
Figure 4. Correlations found between the mRNA levels of genes involved in the regulation of LA and EMT at early stages of cervical cancer development and in the norm.
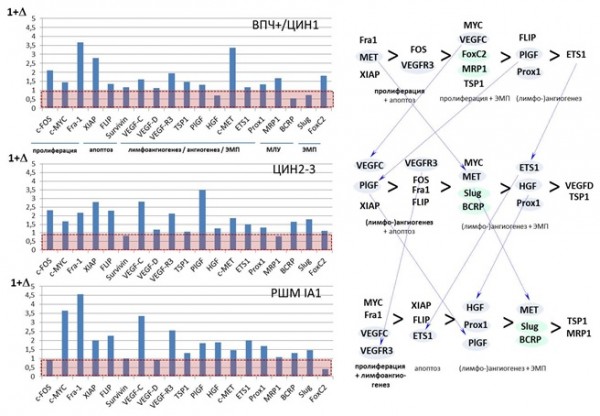
Рисунок 5. Профили относительного изменения экспрессии исследуемых генов (1+D, в % от уровня контроля), характерные для ранних этапов развития инвазивного РШМ. Красная область соответствует уровню контроля, принятому за 1 (100%). D= (Моп – Мнорм)/Мнорм, где Моп – среднегрупповое значение нормализованного уровня мРНК в патологических образцах (ВПЧ+/ЦИН1-3/микрокарцинома), Мнорм – в образцах нормального эпителия (контроль)).
Figure 5. Gene expression profiles (1+D, in % of the control level) obtained for early stages of invasive cervical cancer development. Red area corresponds to the control level, taken as 1 (100%). D= (Мtum – Мnorm)/Мnorm, where Мtum is median value of normalized mRNA level in pathological samples (HPV+/CIN1-3/microcarcinoma), Мnorm is median value of normalized mRNA level in normal epithelium samples (control)).
Заключение
Суммируя полученные результаты, можно заключить, что активация механизмов ЛА («лимфангиогенное переключение») и ЭМП, проявляющаяся в изменении экспрессии целого спектра генов, может осуществляться на очень ранних (преинвазивных) ступенях развития ВПЧ-индуцированного РШМ. Выявленные взаимосвязи между уровнями экспрессии ЛА-/ЭМП-ассоциированных факторов на различных этапах формирования инвазивного фенотипа РШМ могут быть рассмотрены как in vivo свидетельство кросс-регуляции («cross-talk») соответствующих сигнальных путей, исследуемых с помощью различных модельных экспериментальных систем (Рисунок 6).
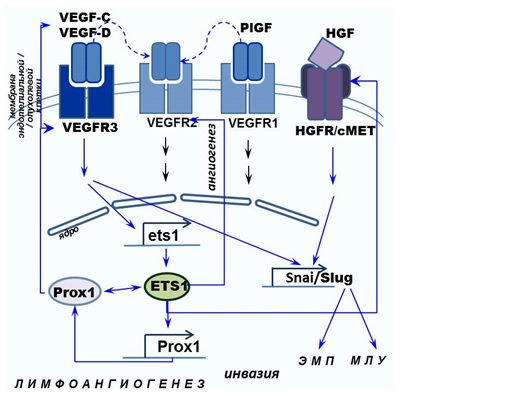
Рисунок 6. Схема регуляторных взаимодействий между исследуемыми молекулярными факторами и генами, контролирующими ЛА и ЭМП.
Figure 6. Regulatory interactions between molecular factors and genes controlling LA/EMT analyzed in this study.
Важно отметить, что активность исследуемых в рамках данной работы генов (в особенности таких, как VEGF-D, PlGF, ETS1) только начинает рассматриваться в контексте проблемы ЛА и ЭМП при раннем развитии опухоли. Более того, в случае предрака и ранних стадий РШМ роль данных факторов в значительной степени не охарактеризована, а имеющаяся информация об их экспрессии основывается преимущественного на результатах иммуногистохимического анализа и касается инвазивного РШМ II-III стадий (см., например, исследования (Yu, 2009) по VEGF-D, (Pallai, 2012) – ETS1, (Cimpean, 2012) – Prox1, (Gong, 2015) – Slug). Это еще раз подчеркивает необходимость дальнейшего всестороннего изучения молекулярных факторов, контролирующих ЛА и ЭМП при развития РШМ, с применением широкого спектра методов и технологий.
Благодарности
Работа поддержана грантом РФФИ (проект № 16-34-60019).
Библиография
1. Cai J, Tian AX, Wang QS, Kong PZ, Du X, Li XQ, Feng YM. FOXF2 suppresses the FOXC2-mediated epithelial-mesenchymal transition and multidrug resistance of basal-like breast cancer. Cancer Lett 2015, 367(2):129-137.
2. Cao R, Björndahl MA, Gallego MI, Chen S, Religa P, Hansen AJ, Cao Y. Hepatocyte growth factor is a lymphangiogenic factor with an indirect mechanism of action. Blood 2006, 107(9):3531-3536.
3. Cimpean AM, Mazuru V, Saptefrati L, Ceausu R, Raica M. Prox 1, VEGF-C and VEGFR3 expression during cervical neoplasia progression as evidence of an early lymphangiogenic switch. Histol Histopathol 2012, 27(12):1543-1550.
4. Cui YM, Jiao HL, Ye YP, Chen CM, Wang JX, Tang N, Li TT, Lin J, Qi L, Wu P, Wang SY, He MR, Liang L, Bian XW, Liao WT, Ding YQ. FOXC2 promotes colorectal cancer metastasis by directly targeting MET. Oncogene 2015, 34(33):4379-4390.
5. Davydova N, Harris NC, Roufail S, Paquet-Fifield S, Ishaq M, Streltsov VA, Williams SP, Karnezis T, Stacker SA, Achen MG. Differential receptor binding and regulatory mechanisms for the lymphangiogenic growth factors VEGF-C and VEGF-D. J Biol Chem 2016, pii: jbc.M116.736801.
6. Dewerchin M, Carmeliet P. PlGF: a multitasking cytokine with disease-restricted activity. Cold Spring Harb Perspect Med 2012, 2(8). pii: a011056.
7. Gibot L, Galbraith T, Kloos B, Das S, Lacroix DA, Auger FA, Skobe M. Cell-based approach for 3D reconstruction of lymphatic capillaries in vitro reveals distinct functions of HGF and VEGF-C in lymphangiogenesis. Biomaterials 2016, 78:129-139.
8. Gong X, Tao Y, Zhou L, Yu L, Wu S, Song W, Wang D, Cheng Z. Expressions of Snail, Slug and KAI1 proteins in cervical carcinoma and their clinicopathological significance. Nan Fang Yi Ke Da Xue Xue Bao 2015, 35(12):1733-1738.
9. Gutierrez KD, Morris VA, Wu D, Barcy S, Lagunoff M. Ets-1 is required for the activation of VEGFR3 during latent Kaposi's sarcoma-associated herpesvirus infection of endothelial cells. J Virol 2013, 87(12):6758-6768.
10. Jeanne A, Schneider C, Martiny L, Dedieu S. Original insights on thrombospondin-1-related antireceptor strategies in cancer. Front Pharmacol 2015, 6:252.
11. Joukov V, Sorsa T, Kumar V, Jeltsch M, Claesson-Welsh L, Cao Y, Saksela O, Kalkkinen N, Alitalo K. Proteolytic processing regulates receptor specificity and activity of VEGF-C. EMBO J 1997, 16(13):3898-3911.
12. Leitao MdCG, Coimbra EC, Lima RdCPd, Guimaraes Mde L, Heraclio Sde A, Silva Neto Jda C, de Freitas AC. Quantifying mRNA and MicroRNA with qPCR in Cervical Carcinogenesis: A Validation of Reference Genes to Ensure Accurate Data. PLoS ONE 2014, 9(11):e111021.
13. Leppänen VM, Tvorogov D, Kisko K, Prota AE, Jeltsch M, Anisimov A, Markovic-Mueller S, Stuttfeld E, Goldie KN, Ballmer-Hofer K, Alitalo K. Structural and mechanistic insights into VEGF receptor 3 ligand binding and activation. Proc Natl Acad Sci U S A 2013, 110(32):12960-12965.
14. Paduch R. The role of lymphangiogenesis and angiogenesis in tumor metastasis. Cell Oncol (Dordr) 2016, 39(5):397-410.
15. Pallai R, Bhaskar A, Sodi V, Rice LM. Ets1 and Elk1 transcription factors regulate cancerous inhibitor of protein phosphatase 2A expression in cervical and endometrial carcinoma cells. Transcription 2012, 3(6):323-335.
16. Pfaffl MW. Relative quantification. In Real-time PCR. Edited by Dorak T. New York: Taylors & Francis Group; 2006: 63-82.
17. Rihani A, Van Maerken T, Pattyn F, Van Peer G, Beckers A, De Brouwer S, Kumps C, Mets E, Van der Meulen J, Rondou P, Leonelli C, Mestdagh P, Speleman F, Vandesompele J. Effective Alu repeat based RT-Qpcr normalization in cancer cell perturbation experiments. PLoS One 2013, 8(8):e71776.
18. Sui H, Zhu L, Deng W, Li Q. Epithelial-mesenchymal transition and drug resistance: role, molecular mechanisms, and therapeutic strategies. Oncol Res Treat 2014, 37(10):584-589.
19. Wang CA, Tsai SJ. The non-canonical role of vascular endothelial growth factor-C axis in cancer progression. Exp Biol Med (Maywood) 2015, 240(6):718-724.
20. Wang J, Huang Y, Zhang J, Wei Y, Mahoud S, Bakheet AM, Wang L, Zhou S, Tang J. Pathway-related molecules of VEGFC/D-VEGFR3/NRP2 axis in tumor lymphangiogenesis and lymphatic metastasis. Clin Chim Acta 2016, 461:165-171.
21. Wu X, Liu NF. FOXC2 transcription factor: a novel regulator of lymphangiogenesis. Lymphology 2011, 44(1):35-41.
22. Yoshimatsu Y, Yamazaki T, Mihira H, Itoh T, Suehiro J, Yuki K, Harada K, Morikawa M, Iwata C, Minami T, Morishita Y, Kodama T, Miyazono K, Watabe T. Ets family members induce lymphangiogenesis through physical and functional interaction with Prox1. J Cell Sci 2011, 124(Pt 16):2753-2762.
23. Yu H, Zhang S, Zhang R, Zhang L. The role of VEGF-C/D and Flt-4 in the lymphatic metastasis of early-stage invasive cervical carcinoma. J Exp Clin Cancer Res 2009, 28:98.
24. Yu P, Tung JK, Simons M. Lymphatic fate specification: an ERK-controlled transcriptional program. Microvasc Res 2014, 96:10-15.