Введение
Цервикальные интраэпителиальные неоплазии (ЦИН) и рак шейки матки (РШМ) составляют одну из наиболее актуальных проблем репродуктивной медицины. Несмотря на значительный успех в сфере ранней диагностики и профилактики ВПЧ-инфекции и ЦИН, уровень заболеваемости инвазивным РШМ среди женщин молодого/среднего репродуктивного возраста и смертности от данной онкопатологии остается по-прежнему высоким, что свидетельствует о наличии ряда неразрешенных фундаментальных вопросов, касающихся механизмов формирования злокачественного потенциала клеток РШМ in vivo. РШМ представляет собой один из наиболее агрессивных типов рака, характеризующихся ранним формированием опухолевой микрососудистой сети, которая способствует быстрой прогрессии и раннему метастазированию. Согласно современным представлениям, как процессы ангиогенеза, так и процессы лимфангиогенеза и их молекулярные регуляторы имеют сопоставимо важное значение для прогрессии РШМ на ранних стадиях, однако, информации об экспрессии данных регуляторов на этапе пре- и микроинвазивного РШМ (стадия 0-IA) недостаточно (Курмышкина, 2015). Особый интерес представляют члены VEGF-семейства (vascular endothelial growth factor), контролирующие развитие лимфатических/кровеносных микрокапилляров, эпителиально-мезенхимного превращения и клеточной миграции – VEGF-C фактор, его рецептор VEGF-R3 и PlGF (placenta growth factor) (Van Trappen, 2003; Dewerchin, 2012), а также специфические проангиогенные транскрипционные факторы, как например, представители ETS-семейства (E26 transformation-specific) (Randi, 2009). Не менее важным и сравнительно малоизученным аспектом проблемы РШМ-ассоциированного неоангиогенеза является вклад иммунного компонента, в частности регуляторных Т-лимфоцитов (Tregs), для которых, помимо иммуносупрессорной, также описана лимфангиогенез-стимулирующая активность (James, 2013). Связующим звеном между Tregs и VEGF-C-зависимыми процессами неоангиогенеза является трансформирующий фактор роста TGFb – ключевой цитокин, секретируемый Tregs и стимулирующий VEGF-опосредованный сигналинг (Facciabene, 2012).
Целью работы являлось исследование изменений уровня экспрессии генов VEGF-C, VEGF-R3, PlGF, ETS1 в образцах пре- и микроинвазивного РШМ, в сравнении с нормальным эпителием, а также определение отклонений в численности субпопуляции циркулирующих CD4-Tregs и уровня TGFb плазмы крови в указанных группах больных относительно группы здоровых доноров.
Материалы и методы
Биоматериал был получен от пациенток ГБУЗ Республиканский онкологический диспансер, давших добровольное согласие на участие в исследовании. Образцы патологического эпителия были получены в ходе операции конизации от 10 пациенток с плоскоклеточной карциномой in situ (РШМ 0 стадии) и 5 пациенток с микроинвазивным РШМ (РШМ IA стадии). В каждом случае, первоначальный диагноз был верифицирован методом гистологического анализа. Позитивный ВПЧ-статус был подтвержден с помощью ПЦР-диагностики. Также фрагменты нормального цервикального эпителия были получены в условиях женской консультации от 5 женщин с негативным ВПЧ-статусом. Тотальная РНК была выделена из биоматериала с помощью реагента TriZOL («Invitrogen», США) и переведена в кДНК с использованием набора для обратной транскрипции ProtoScript II First Strand cDNA Synthesis kit («New England BioLabs», Великобритания). Анализ уровня экспрессии генов проводили методом ПЦР в режиме реального времени на приборе StepOnePlus («ABI Technologies», США) c использованием реакционной смеси qPCRmix-HS SYBR+HighROX и ген-специфических праймеров, синтезированных компанией «Евроген» (Москва). Изменение уровня мРНК исследуемых генов при РШМ 0-IA стадии относительно нормального эпителия оценивали по методу –DDCt (Livak, 2001) с учетом различий в эффективности амплификации (Е%), которую определяли методом кривых разведения кДНК-матрицы для каждой пары праймеров (Pfaffl, 2006); в качестве референсного гена использовали EEF1A1 (Leitao, 2014). Последовательности праймеров, условия амплификации и другие характеристики указаны в Таблице.
Таблица. Характеристика праймеров к нуклеотидным последовательностям исследуемых генов
| Ген | NCBI RefSeq | Последовательность/локализация
(F – прямой праймер, R – обратный праймер) |
Размер ампли-кона, п.о. /
Е % |
Т °С
отжига |
Источник |
| EEF1A1 | NM_ 001402.5 | F:5'-GTTGCGGTGGGTGTCATCA-3'
(экзон 8) |
123 / 99 | 60 | (Leitao, 2014) |
| R:5'-GAGTGGGGTGGCAGGTATT-3'
(экзон 8) |
|||||
| VEGF-C | NM_ 005429.4 | F:5'-CACGGCTTATGCAAGCAAAGA-3'
(экзон 1) |
120 / 108 | 56 | (Pringels, 2012) |
| R:5'-TCCTTTCCTTAGCTGACACTTGT-3' (экзон 2) | |||||
| VEGF-R3 | NM_ 182925.4 | F:5'-AGTACATCAAGGCACGCATCGA-3'
(экзон 3) |
102 / 110 | 56 | (Yoshimat-su, 2011) |
| R:5'-ACCAAGAGCGTGTCAGGCTTGT-3' (экзон 4) | |||||
| PlGF | NM_ 002632.5 | F:5'-CAGAGGTGGAAGTGGTACCCTTC
C-3' (экзон 2) |
223 / - | 60 | (Depoix, 2011) |
| R:5'-CGGATCTTTAGGAGCTGCATGGTG
AC-3' (экзон 4) |
|||||
| ETS1 | NM_ 001143820.1 | F:5'-ACATCATCCACAAGACAGCGG-3'
(экзон 10) |
50 / 102 | 60 | (Yoshimat-su, 2011) |
| R:5'-CACACACAAAGCGGTACACGT-3'
(экзон 10) |
Образцы крови были получены от 35 пациенток с пре- и микроинвазивным РШМ непосредственно перед операцией. Контрольную группу составили 30 здоровых женщин, не имеющих патологий шейки матки и ВПЧ-инфекции. Иммунофенотипирование CD4-Tregs проводилось методом проточной цитофлуориметрии на приборе MACSQuant («Miltenyi Biotec», Германия) с использованием флуорофор-меченных моноклональных антител против CD-антигенов человека: CD4-FITC, CD25-APC, CD127-RPE, анти-FoxP3-RPE («Dako», Дания; «Miltenyi Biotec», Германия). В каждой пробе анализировали не менее 30 тыс. клеток. Содержание TGFb1 в плазме крови больных и контрольной группы оценивалось методом иммуноферментного анализа с использованием набора Platinum ELISA («eBioscience», США); определение оптической плотности проводилось на приборе SpectraMax i3 («Molecular Devices», США). Статистическая достоверность оценивалась согласно критерия Уилкоксона-Манна-Уитни (при р
Результаты
Было установлено, что экспрессия генов VEGF-C, VEGF-R3, PlGF и ETS1 существенно увеличена в клетках РШМ, по сравнению с нормальным цервикальным эпителием (Рисунок 1). Также можно говорить о тенденции к увеличению содержания мРНК исследуемых генов по мере прогрессии опухоли от интраэпителиальной формы (0 стадия) к инвазивной (IA стадия), однако, достоверность этих различий на данном этапе работы не подтверждается. Полученный результат указывает на очень раннее формирование лимфангиогенного профиля РШМ – на этапе преинвазивного роста, что, очевидно, является необходимой предпосылкой для последующей диссеминации опухолевых клеток. Наблюдаемое лимфангиогенное «переключение» затрагивает разные уровни – уровень ростовых факторов (VEGF-C, PlGF), их рецепторов (VEGF-R3) и эндотелий-специфичных внутриклеточных транскрипционных факторов (ETS1).
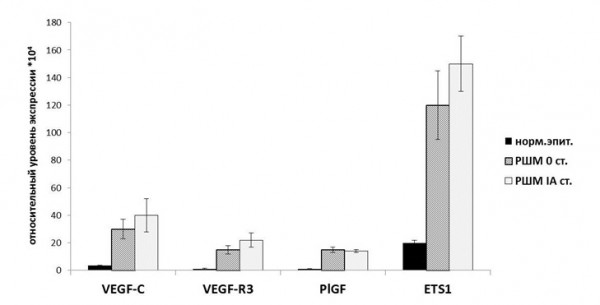
Рисунок 1. Изменение уровня экспрессии генов-регуляторов ангиогенеза в образцах РШМ относительно нормального эпителия. На гистограммах приведены средние значения и значения стандартных ошибок [M±m].
Figure 1. The change of expression levels of genes regulating angiogenesis in samples of cervical cancer (0-IA stage) vs. normal epithelium. Means and standard errors for each group are shown [M±m].
Также нами была проанализирована численность регуляторных Т-лимфоцитов (Tregs) периферической крови, описываемых фенотипом CD4(+)CD25(+/high)CD127(dim/neg)FoxP3(+) (Whiteside, 2012; Chen, 2013). Схема выделения интересующей клеточной субпопуляций (gating strategy) отражена на Рисунке 2. В группе больных РШМ 0-IA стадии было обнаружено увеличение количества CD4-Tregs, в сравнении с группой здоровых доноров (Рисунок 3), а именно зафиксировано достоверное повышение содержания клеток с фенотипом CD4(+)CD25(+) (в особенности, фракции CD4(+)CD25(high), характеризующейся наибольшей иммуносупрессорной активностью), CD4(+)CD25(+)CD127(dim/neg) и CD4(+)CD25(+)FoxP3(+). Значимых различий в отношении численности данной субпопуляции лимфоцитов между группами РШМ 0 и IA стадии выявлено не было. Аналогичная зависимость получена для уровня TGFb1 в плазме крови испытуемых: для группы контроля его концентрация составила 8.7 ± 2.7 нг/мл, в то время как в группе больных пре-/микроинвазивным раком наблюдалось заметное повышение концентрации (28.4 ± 4.7 нг/мл и 22.7 ± 5.8 нг/мл для РШМ 0 и IA стадий, соответственно); закономерных различий между группами пациенток не наблюдалось. Исходя из полученных данных, можно предположить, что распространение Tregs в циркуляции и увеличение уровня секретируемого ими TGFb1, способного индуцировать экспрессию факторов VEGF-сигнального пути опухолевыми и эндотелиальными клетками, происходит на наиболее ранних этапах развития РШМ.
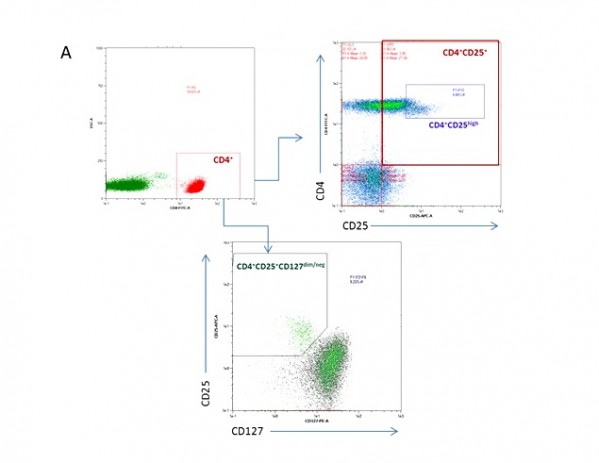
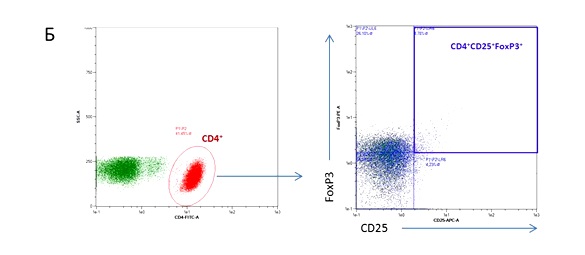
Рисунок 2. Схема анализа CD4 регуляторных Т-лимфоцитов (Tregs) с фенотипом CD4(+)CD25(+/high)CD127(dim/neg) (А) и CD4(+)CD25(+)FoxP3(+) (Б) методом проточной цитофлуориметрии.
Figure 2. Scheme of gating the population of CD4 regulatory T-cells described by phenotypes: CD4(+)CD25(+/high)CD127(dim/neg) (A) and CD4(+)CD25(+)FoxP3(+) (B) using multi-color flow cytometry.
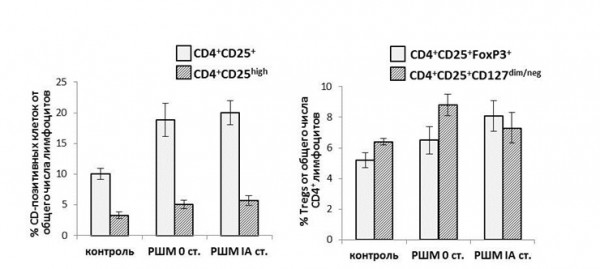
Рисунок 3. Изменение численности Tregs в периферической крови больных РШМ 0 и IA стадий по данным проточной цитофлуориметрии.
Figure 3. The change of circulating Tregs percentages in stage 0-IA cervical cancer patients vs. healthy donors.
Заключение
Таким образом, у больных ранними формами РШМ наблюдаются скоординированные изменения исследованных показателей, как на локальном, так и на системном уровнях, направленные на стимуляцию неоангиогенеза и, очевидно, формирующие основу для инвазии и раннего метастазирования клеток опухоли. Выявленные закономерности не только отражают возможные механизмы патогенеза РШМ, но также могут быть использованы для разработки методов ранней диагностики и лечения данного заболевания.
Благодарности
Работа выполнена при поддержке грантов НК-1404-32098 (РФФИ), 11.G34.31.0052 (Постановление 220), Программы стратегического развития ПетрГУ на 2012-2016 гг. и Гос. задания на НИР.
Библиография
1. Chen Z, Ding J, Pang N, Du R, Meng W, Zhu Y, Zhang Y, Ma C, Ding Y. The Th17/Treg balance and the expression of related cytokines in Uygur cervical cancer patients. Diagn Pathol 2013, 8:61.
2. Depoix C, Tee MK, Taylor RN. Molecular regulation of human placental growth factor (PlGF) gene expression in placental villi and trophoblast cells is mediated via the protein kinase a pathway. Reprod Sci 2011, 18(3):219-228.
3. Dewerchin M, Carmeliet P. PlGF: a multitasking cytokine with disease-restricted activity. Cold Spring Harb Perspect Med 2012, 2(8):a011056.
4. Facciabene A, Motz GT, Coukos G. T-regulatory cells: key players in tumor immune escape and angiogenesis. Cancer Res 2012, 72(9):2162-2171.
5. James JM, Nalbandian A, Mukouyama YS. TGFβ signaling is required for sprouting lymphangiogenesis during lymphatic network development in the skin. Development 2013, 140(18):3903-3914.
6. Leitao MdCG, Coimbra EC, Lima RdCPd, Guimaraes Mde L, Heraclio Sde A, Silva Neto Jda C, de Freitas AC. Quantifying mRNA and MicroRNA with qPCR in Cervical Carcinogenesis: A Validation of Reference Genes to Ensure Accurate Data. PLoS ONE 2014, 9(11):e111021.
7. Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 2001, 25(4):402-408.
8. Pfaffl MW. Relative quantification. In Real-time PCR. Edited by Dorak T. New York: Taylors & Francis Group; 2006: 63-82.
9. Pringels S, Van Damme N, De Craene B, Pattyn P, Ceelen W, Peeters M, Grooten J. Clinical procedure for colon carcinoma tissue sampling directly affects the cancer marker-capacity of VEGF family members. BMC Cancer 2012,12:515.
10. Randi AM, Sperone A, Dryden NH, Birdsey GM. Regulation of angiogenesis by ETS transcription factors. Biochem Soc Trans 2009, 37(Pt 6):1248-1253.
11. Van Trappen PO, Steele D, Lowe DG, Baithun S, Beasley N, Thiele W, Weich H, Krishnan J, Shepherd JH, Pepper MS, Jackson DG, Sleeman JP, Jacobs IJ. Expression of vascular endothelial growth factor (VEGF)-C and VEGF-D, and their receptor VEGFR-3, during different stages of cervical carcinogenesis. J Pathol 2003, 201(4):544-554.
12. Whiteside TL, Schuler P, Schilling B. Induced and natural regulatory T cells in human cancer. Expert Opin Biol Ther 2012, 12(10):1383-1397.
13. Yoshimatsu Y, Yamazaki T, Mihira H, Itoh T, Suehiro J, Yuki K, Harada K, Morikawa M, Iwata C, Minami T, Morishita Y, Kodama T, Miyazono K, Watabe T. Ets family members induce lymphangiogenesis through physical and functional interaction with Prox1. J Cell Sci 2011, 124(Pt 16):2753-2762.
14. Курмышкина О.В., Белова Л.Л., Ковчур П.И., Волкова Т.О. Ремоделирование ангиогенеза и лимфангиогенеза при развитии рака шейки матки // Биомедицинская химия. – 2015. – Т.61. – Вып.5. – С. 579-597.