Введение
Активные меры, предпринимаемые медициной по устранению или уменьшению влияния факторов риска, способствовали снижению смертности от заболеваний сердца и сосудов. Однако смертность населения России от сердечно-сосудистых патологий остается по-прежнему высокой. Артериальная гипертензия (АГ) является патологическим процессом, ассоциированным с ремоделированием сосудов сердца, который характеризуется качественными и количественными изменениями в содержимом внеклеточного матрикса (ВКМ) (Bashey, 1989). При АГ важным аспектом ремоделирования ВКМ является отложение коллагена и других компонентов ВКМ на стенках сосуда с последующим изменением его свойств. На сегодняшний день не вызывает сомнений ведущая роль ренин-ангиотензин-альдостероновой системы в механизме развития АГ. После повреждения сосуда важными факторами, влияющие на обновление ВКМ при ремоделировании ткани в процессе развития атеросклероза или при гипертонической патологии, являются ангиотензин II (АТ II), выступающего в качестве мощного пептида-эффектора ренин-ангиотензин-альдостероновой системы, а также специфичные протеиназы (Zhou, 2004).
Процессы деградации коллагена главным образом регулируются за счет функционирования матриксных металлопротеиназ (ММП), обладающих широким спектром биологических функций. Они играют ключевую роль в разрушении большинства компонентов ВКМ при различных патогенетических вариантах воспаления, сердечнососудистых заболеваниях, инфекционных, аутоиммунных и аллергических реакций, злокачественной трансформации клеток (Nanni, 2007; Хасигов, 2000). Ведущая роль среди металлопротеиназ отводится металлопротеиназе-3 (ММП-3) (Zhou, 2004). Полиморфизм генов ММП-1, ММП-3, ММП-9 влияет на уровень их транскрипционной активности. Однонуклеотидная замена ММП-3 5A/6A, содержащая 5 или 6 остатков аденозина, находится в промоторной области MMП-3. Ряд генетических эпидемиологических исследований вариантов гена ММП-3 5A/6A показали, что данный полиморфизм связан с различными сердечно-сосудистыми заболеваниями в разных этнических группах. Целью настоящего исследования являлось изучение возможности использования полиморфных вариантов гена матриксной металлопротеиназы-3 (ММП-3) в качестве маркера риска развития сердечно-сосудистой патологии в норме и при артериальной гипертензии у населения Республики Карелия.
Материалы и методы
В работе использованы образцы крови 174 условно здоровых доноров без клинических проявлений и диагноза АГ, ишемической-болезни сердца (ИБС) (контрольная группа) и 198 образцов крови больных. Заболевание диагностировали согласно IV пересмотру рекомендаций Всероссийского научного общества кардиологов по АГ от 2010 г. Все обследованные пациенты подписывали информированное согласие на участие в исследовании. Среди обследованных были только люди русской национальности (по результатам анкетирования). Критерии включения для больных: впервые установленный диагноз АГ (I-II стадии, степень АГ 1-2), отсутствие гипотензивной терапии, установленный диагноз ОИМ (острый инфаркт миокарда); критерии включения в контрольную группу: отсутствие клинических проявлений и установленных диагнозов АГ и ИБС. Критерии исключения, общие для доноров всех изучаемых групп: курение, беременность и лактация, алкогольная зависимость, сахарный диабет, индекс массы тела ≥30 кг/м2. Критерии исключения из контрольной группы объединяли критерии, установленные для больных АГ и ОИМ.
ДНК выделяли из крови с помощью наборов для выделения ДНК Axyprep (Axygen, США) согласно инструкции производителя. Качество и количество выделенной ДНК оценивали спектрофотометрически (SmartSpec Plus, Bio-Rad, США). Для амплификации промоторной части гена металлопротеиназы-3 использовали следующие праймеры: прямой 5’-GGTTCTCCATTCCTTTGATGGGGGGAAAGA-3’ и обратный 5'-CTTCCTGGAATTCACATCACTGCCACCACT-3'. Полимеразную цепную реакцию (ПЦР) проводили в амплификаторе iCycler iQ5 (Bio-Rad, США). Реакционная смесь для ПЦР объемом 30 мкл содержала: 50 нг ДНК исследуемых образцов, 100 пМ обратного и прямого праймеров, 1 ед.а. Taq полимеразы (Силекс, Россия), 0,2 мМ dNTP, 2,5 мкл 10хбуфера для Taq полимеразы, согласно инструкции к набору для ПЦР (Силекс, Россия). Условия ПЦР: денатурация – 2 мин при 94С, отжиг – 1 мин при 65С, элонгация – 1 мин при 72С; количество циклов – 35; достраивание фрагментов – 10 мин при 72С. Полученный ПЦР продукт подвергался обработке рестриктазой TthI (Сибэнзим, Россия) в течение 3 ч при 65°С для идентификации аллелей 6A (130 п.н.) и 5A (97 п.н.). ПЦР-продукты разделяли в 8%-ном полиакриламидном геле, используя трис-боратный буфер. ПЦР-продукты окрашивали бромистым этидием, визуализировали в проходящем УФ свете и анализировали с помощью программы Kodak 1D.
Липидный спектр определяли на анализаторе COBAS INTEGRA 400 PLUS (Roсhe Diagnostics GmbH, Германия). Методы определения: общего холестерина (ОХС) и триглицеридов (ТГ) – энзиматический колориметрический; холестерина липопротеинов высокой плотности (ХС-ЛПВП) – энзиматический калориметрический, прямой; холестерина липопротеинов низкой плотности (ХС-ЛПНП) – расчетный, по формуле Фридвальда. Экспериментальные данные обрабатывали с использованием статистических приложений программы Microsoft Excel и Statgraphics2.1 (ANOVA).
Результаты и обсуждение
Анализ результатов генотипирования показал, что в изученной выборке частоты аллелей 5A и 6A гена ММР-3 достоверно не отличаются в группах здоровых пациентов и больных АГ+ИБС (39/61 и 40/60 соответственно, р=0.75). Закон Харди-Вайнберга в данном случае соблюдается как в группе здоровых доноров, так и среди больных АГ и ИБС (Таблица 1). Тест на соответствие равновесию Харди-Вайнберга χ2=1.26 (p > 0.05). Частоты генотипов 5А5А, 5А6А и 6А6А в группе АГ составили 13%, 53% и 34%, соответственно, по сравнению с контрольной группой 15%, 47% и 37%, соответственно (р=0.665; N=174) (Таблица 1).
Таблица 1. Частотное распределение аллелей и генотипов полиморфных вариантов ММР-3 (5A/6A) в контрольной группе и группах больных ЭАГ и ИБС
| Генотип/
Аллели |
Контроль, N (%) | Больные АГ+ИБС, N (%) | P |
| 5A5A | 30(15) | 23(13) | 0.79 |
| 5A6A | 94(47) | 92(53) | 0.92 |
| 6A6A | 74(37) | 58(34) | 0.45 |
| 5A | 77(39) | 69(40) | 0.83 |
| 6A | 121(61) | 104(60) | 0.65 |
При анализе частот генотипов ММП-3 среди мужчин и женщин не было выявлено достоверных различий между больными и группой контроля. Следует отметить, что между мужчинами и женщинами обнаружено недостоверное различие по распределению частот генотипа 5A5A 18% против 13% для контрольной группы (Рисунок 1). Результаты по частотам генотипов данного маркера ММП-3 для женщин полностью повторяют результаты работы новосибирских исследователей (Маздорова, 2010).
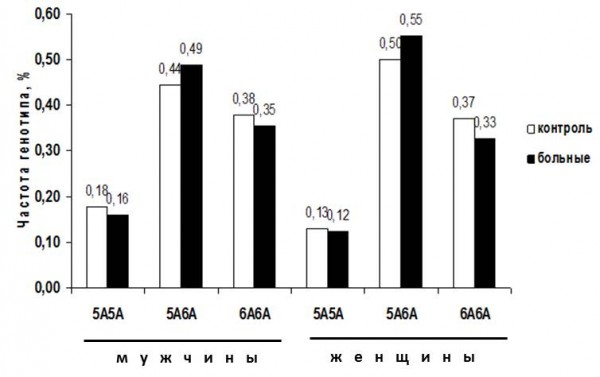
Рисунок 1. Частоты распределения генотипов ММП-3 (5А6А) в зависимости от наличия АГ и ИБС (выборка мужчин и женщин, 18-60 лет, n=174 и n=198, г. Петрозаводск).
Figure 1. Frequencies of MMP-3 genotypes (5A6A) in relation to arterial hypertension + coronary heart disease (sample consisted of men and women of 18-60 years old, n=174 and n=198, Petrozavodsk).
При анализе биохимических показателей нами обнаружено, что гомозиготы в 5А5A ММП-3 ассоциированы с повышенным содержанием глюкозы, ОХС и ТГ в группе больных АГ и ИБС. Кроме того, генотип 5А5A был ассоциирован с пониженными уровнями ОХС, ЛПВП и ЛПНП по сравнению с носителями аллели 6A и гетерозиготами в контрольной группе (Таблица 2).
Таблица 2. Генотипы ММП-3 и биохимические показатели у здоровых и больных
| Биохимические показатели | Генотип | Контрольная группа | Группа людей, страдающих АГ+ИБС |
| ОХС, ммоль/л | 5А5A | 4.89±0.72 | 6.35±1.05 |
| 5A6A | 5.60±0.89 | 6.39±0.82 | |
| 6A6A | 6.17±0.92* | 5.49±0.78 | |
| ХС-ЛПВП, ммоль/л | 5А5A | 1.48±0.18 | 1.37±0.09 |
| 5A6A | 1.47±0.07 | 1.37±0.12 | |
| 6A6A | 1.53±0.12 | 1.45±0.09 | |
| ХС-ЛПНП, ммоль/л | 5А5A | 2.82±0.58 | 3.74±0.42 |
| 5A6A | 3.94±0.63 | 4.17±0.49 | |
| 6A6A | 4.26±0.44** | 3.35±0.54 | |
| ТГ, ммоль/л | 5А5A | 1.31±0.09 | 2.58±0.68 |
| 5A6A | 1.38±0.08 | 1.93±0.47 | |
| 6A6A | 1.40±0.07 | 1.51±0.47 | |
| Глюкоза, ммоль/л | 5А5A | 4.45±0.37 | 6.52±0.82 |
| 5A6A | 4.45±0.29 | 5.37±0.67 | |
| 6A6A | 4.38±0.28 | 4.87±0.79 |
*- p=0.031(ANOVA); **- p=0.01(ANOVA)
При анализе биохимических показателей у носителей разных генотипов по данному маркеру в группах мужчин и женщин достоверных различий выявлено не было. Далее с помощью дисперсионного анализа была показана достоверная корреляция для ОХС и ЛПНП с генотипами ММП-3 только в группе контроля, расчетное влияние признаков 7.49% и 11.7%, соответственно (Таблица 2).
Ведущая роль в деградации коллагена ВКМ и растворении атеросклеротических бляшек отводится металлопротеиназе-3 (ММП-3) (Bashey, 1989; Nanni, 2007; Zhou, 2004; Хасигов, 2000). Однонуклеотидная замена ММП-3 5A/6A, содержащая 5 или 6 остатков аденозина, находится в промоторной области MMП-3. 6А аллель ассоциирована со снижением экспрессии ММП и ускоренным развитием атеросклероза из-за повышения уровня коллагена во внеклеточном матриксе артерий. В литературе имеются данные о различиях биохимических показателей в плазме крови у носителей разных полиморфных вариантов генов металлопротеиназ. Например, в работе исследователей из Новосибирска обнаружена ассоциация признаков каротидного атеросклероза с гомозиготным генотипом 5А5А гена ММП-3 у мужчин, которая не зависела от возраста и уровня артериального давления (Маздорова, 2010). Полученные нами результаты об отсутствии ассоциации гипертензии с гомозиготным генотипом 5А5А гена ММП-3 у русского населения Республики Карелия не отличаются от данных большинства опубликованных работ, где получены ассоциации данных заболеваний как с аллелью 6А, так и с аллелью 5A, либо отсутствие ассоциаций (Маздорова, 2010; MacNaul, 1990). У женщин Японии была найдена связь инфаркта миокарда с носительством аллели 6А гена ММП-3. (Frisch, 1987). В других работах показана прямая или опосредованная ассоциация генотипа 5А5А с инфарктом миокарда (MacNaul, 1990; Frisch, 1987). Данные о роли 5A аллели поддерживаются результатами недавнего мета-анализа о предполагаемой связи этого алельного варианта с нестабильностью атеросклеротической бляшки из-за повышенного протеолиза (Yamada, 2006). Это разнообразие оценок может объясняться различиями в этническом составе и объеме обследованных выборок, учетом в анализе ряда дополнительных факторов.
Наличие фракции ЛПНП в плазме крови считается признаком нарушения нормального метаболизма липидов и ассоциируется с развитием ИБС. По данным литературы, среди генов, экспрессия которых регулируется металлопротеиназой-3, оказались гены медиаторов воспаления (интерлейкин-1β, транскрипционный комплекс NF-kB). В связи с тем, что большинство генов, кодирующих провоспалительные белки, содержат последовательности для связывания с промоторной областью ММП-3 (Yamada, 2006), можно предположить, что однонуклеотидные замены в гене ММП-3 могут влиять на уровень экспрессии этих генов. Следовательно, один из возможных механизмов различий уровней липопротеинов в плазме крови у носителей разных генотипов гена ММП-3 может представлять собой регуляцию на уровне транскрипции интерлейкинов и других генов-мишеней, вовлеченных в атеросклероз.
В настоящей работе не обнаружено значимых различий в содержании ряда биохимических показателей в плазме крови у носителей разных генотипов по полиморфным маркерам гена ММП-3. Показано, что в контрольной выборке регистрируется достоверное (Таблица 2) влияние полиморфных вариантов гена ММП-3 на уровни атерогенной фракции липидов (ХС-ЛПНП и ОХС) в плазме крови, по сравнению с группой больных. Таким образом, можно заключить, что полиморфные варианты гена ММП-3 в представленной выборке населения Республики Карелия самостоятельно не могут вносить вклад в развитие сердечно-сосудистых патологий.
Выводы
1. Частоты аллелей и генотипов полиморфных вариантов гена ММП-3 (5A/6A) достоверно не отличаются в группах здоровых пациентов и больных АГ.
2. Генотипы ММП-3 достоверно коррелируют с уровнем ОХС и ЛПНП в группе здоровых людей. В группе больных данной взаимосвязи не наблюдается.
Благодарности
Работа выполнена при финансовой поддержке программы Президиума РАН «Фундаментальные науки - медицине» и Программы стратегического развития ПетрГУ.
Библиография
1. Bashey RI, Cox R, McCann J, Jimenez SA. Changes in collagen biosynthesis, types, and mechanics of aorta in hypertensive rats. J Lab Clin Med 1989, 113(5):604-611.
2. Frisch SM, Ruley HE. Transcription of the stromelysin promoter is induced by interleukin-1 and repressed by dexamethasone. J Biol Chem 1987, 262(34):16300-16304.
3. MacNaul KL, Chartrain N, Lark M, Tocci MJ, Hutchinson NI. Discoordinate expression of stromelysin, collagenase and tissue inhibitor of metalloproteinases-1 in rheumatoid human synovial fibroblasts. Synergistic effects of interleukin-1 and tumor necrosis factor- on stromelysin expression. J Biol Chem 1990, 265(28):17238-17245.
4. Nanni S, Melandri G, Hanemaaijer R, Cervi V, Tomasi L, Altimari A, Van Lent N, Tricoci P, Bacchi L, Branzi A. Matrix metalloproteinases in premature coronary atherosclerosis: influence of inhibitors, inflammation, and genetic polymorphisms. Transl Res 2007, 149(3):137-144.
5. Yamada Y. Identification of genetic factors and development of genetic risk diagnosis systems for cardiovascular diseases and stroke. Circ J 2006, 70(10):1240-1248.
6. Zhou X, Huang J, Chen J, Su S, Chen R, Gu D. Haplotype analysis of the matrix metalloproteinase 3 gene and myocardial infarction in a Chinese Han population. The Beijing atherosclerosis study. Thromb Haemost 2004, 92(4):867-873.
7. Маздорова Е.В., Рябиков А.Н., Максимов В.Н., Малютина С.К., Воевода М.И., Никитин Ю.П. Связь каротидного атеросклероза с полиморфизмом 5А/6А гена матричной металлопротеиназы-3 // Бюллетень СО РАМН. – 2010. – Т.30. – №6. – С.46–51.
8. Хасигов П.З., Кзоева С.А., Гатагонова Т.М., Тареева И.Е., Грачев С.В., Березов Т.Т. Роль металлопротеиназ матрикса в развитии диабетической нефропатии // Биохимия. – 2000. – Т.65. – №5. – С.613–619.