Введение
Среди производных пиримидинов (1,3-диазинов), имеющих биологическое значение, наиболее важны гидрокси- и аминопроизводные (Тюкавкина, 2015). Именно благодаря наличию этих функциональных групп между комплементарными основаниями образуются водородные связи в нуклеиновых кислотах. Целью данной работы является выяснение вопроса, возможна ли стабилизация комплексов металлопорфиринов (МП) с пиримидин-содержащими лигандами за счет образования подобных связей с участием аминогрупп.
Материалы и методы
Электронные спектры снимали на приборе СФ 2000-02 («ОКБ Спектр», Россия). Константы устойчивости комплексов Zn-тетрафенилпорфина (Zn-ТФП) с 2-аминопиридином и 2-аминопиримидином в хлороформе определяли, как описано в работе (Андреев, 2012).
Термодинамические константы процесса комплексообразования рассчитывали графическим методом с учетом формулы (первое приближение Улиха) (Никольский, 1987)
ln KT = –ΔH°298 /R T + ΔS°298/R,
предполагая, что в исследуемом узком интервале температур (273–313 К) значения ΔH и ΔS остаются постоянными.
Рентгеноструктурные исследования монокристаллов проводили на дифрактометре STADIVARI Pilatus 100K (STOE, Германия), CuKα-излучение. Сбор данных, определение и уточнение параметров элементарной ячейки, обработка дифракционных данных проведены посредством пакета программ STOE X-Area. Структура решена прямым методом, реализованным в комплексе программ SHELXS-97 (Sheldrick, 2008). Уточнение позиционных и тепловых параметров неводородных атомов проведено в полноматричном анизотропном приближении. Положения атомов водорода рассчитывали и уточняли в изотропном приближении по модели «наездника».
Результаты и обсуждение
В монографии (Андреев, 2015) рассматривается комплексообразование в хлороформе Zn-тетрафенилпорфина (Zn-ТФП) с различными типами аминов, в том числе с пиридинами. В данной работе мы решили выяснить особенности поведения 2-аминопиридина и 2-аминопиримидина, поскольку они являются ключевыми соединениями для синтеза многих биологически активных соединений, в частности, лекарственных препаратов, содержащих в своей основе пиридиновое или пиримидиновое кольцо. Полученные нами значения констант устойчивости и термодинамические параметры образования комплексов Zn-ТФП с этими лигандами даны в Таблице.
Ожидалось, что 2-аминопиридин в соответствии с более высокой основностью (Таблица), по сравнению с 2-аминопиримидином, будет обладать и более высокой нуклеофильностью, способностью к координации с МП (К). Однако оказалось, что он образует менее прочный комплекс с Zn-ТФП. Для объяснения этого феномена мы смешали в эквимолярном соотношении (1:1) Zn-ТФП с 2-аминопиримидином в ацетоне, выделили выпавшие кристаллы и исследовали их методом рентгеноструктурного анализа.
Согласно данным рентгеноструктурного анализа, выделенный нами комплекс (Рисунок) включает молекулы растворителя (ацетон) и имеет состав Zn-ТФП/ 2-аминопиримидин/ ацетон = 2:2:1. При этом, если молекулы ацетона никак не связаны ни с металлопорфирином, ни с лигандами, то атом азота 2-аминопиримидина образует донорно-акцепторную связь с атомом цинка и выводит его из плоскости порфиринового кольца
Таблица. Константы устойчивости (К), термодинамические величины (ΔG0, ΔH0, ΔS0) образования молекулярных комплексов Zn-ТФП и смещения максимумов (Δλ) полос поглощения I и II в электронных спектрах Zn-ТФП при комплексообразовании с 2-аминопиридином и 2-аминопиримидином в хлороформе при 25°С
| Лиганд | К298 | pKa*
(25˚C) |
ΔλII | ΔλI | -ΔH0, кДж·моль-1 | ΔS0,
Дж·моль-1K-1 |
| 2-аминопиридин | 670 ± 30 | 6.86 (5.23) | 14.2 | 15.8 | 17.81±0.36 | -5.5 ±1.5 |
| 2-амино-пиримидин | 910 ± 30 | 3.54 (1.30) | 11.6 | 11.8 | 17.33 ±0.72 | -1.5± 2.3 |
| пиридин | 3520± 150 | 5.29 | 15.0 | 18.2 | 17.29 ± ± 0.17 | 8.9 ± 0.6 |
| 4-аминопиридин | 17460 ± ± 380 | 9.17 | 17.5 | 20.7 | 10.50 ± ± 0.44 | 46.0 ± 2.0 |
Примечание. *Источники: Альберт, 1966; Albert, 1948; Schofield, 1976; Kadish, 1981; Catalan, 1987.
на 0.341Å. Длина связи Zn–N равна 2.252Å, а угол между плоскостями порфиринового и пиримидинового колец составляет 85.50 градуса.
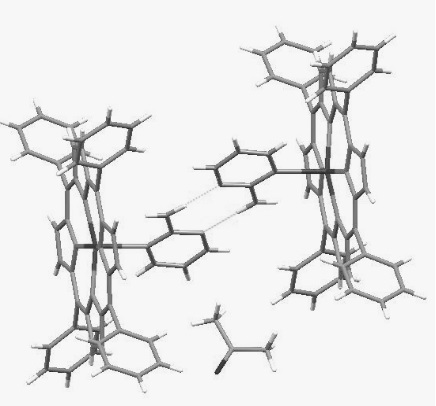
Рисунок. Строение молекулярного комплекса Zn-тетрафенилпорфина с
2-аминопиримидином (внизу – молекула ацетона).
Figure. The stricture of molecular complex of Zn-tetraphenylporphyne with
2-aminopyrimidine (acetone molecule is depicted at the bottom).
Из Рисунка видно, что повышенная стабильность комплекса Zn-ТФП с 2-аминопиримидином в форме димера обусловлена образованием водородных связей между двумя молекулами лигандов (аналогичным образом образуются межмолекулярные водородные связи между комплементарными основаниями в ДНК, а также при их узнавании в составе транспортной РНК в рибосомах). Отметим, что в случае комплексообразования Zn-ТФП с 2-аминопиридином формирование подобных димеров за счет водородной связи исключено, поскольку в ароматическом кольце гетероцикла отсутствует второй атом азота. Увеличение же констант устойчивости (Таблица) в этом направлении связано с тем, что в последних двух лигандах нет заместителей рядом с атомом азота, мешающих взаимодействию с атомом цинка в МП, а в 4-аминопиридине электронодонорная группа облегчает этот процесс.
Анализ термодинамических параметров Таблицы показывает, что с увеличением значений констант устойчивости (К) возрастают как ΔH0, так и ΔS0. Неподчинение подобной зависимости величин Δλ для комплекса Zn-ТФП с 2-аминопиримидином подтверждает, что и в растворе в этом случае образуются димеры.
Заключение
Таким образом, нами показано, что как в твердой фазе, так и в растворах аминопиримидины, в отличие от их пиридиновых производных, могут при координации с металлопорфиринами за счет образования между собой водородных связей создавать ассоциаты. Этот факт помогает лучше понять механизмы взаимодействия лекарственных препаратов (содержащих в своем составе пиримидиновые производные) с гемсодержащими белками, а также координацию в клетках металлопорфиринов, используемых в качестве фотосенсибилизаторов при фотодинамической терапии рака.
Благодарности
Рентгеноструктурные исследования выполнены с использованием оборудования, приобретенного за счет средств Программы развития Московского государственного университета и в рамках Договора о сотрудничестве между химическим факультетом Московского государственного университета и эколого-биологическим факультетом Петрозаводского государственного университета.
Библиография
1. Albert A, Goldacre R, Phillips J. The Strength of Heterocyclic Bases. Journal of the Chemical Society 1948, 2:2240-2248.
2. Catalan J, Abboud JL, Elguero J. Basicity and Acidity of Azoles. Advances in Heterocyclic Chemistry 1987, 41:187-274.
3. Kadish KM, Shiue LR, Rhodes RK, Bottomley LA. Reaction of metalloporphyrins π radicals. Complexation of Zinc Tetraphenylporphin cation and anion radicals with nitrogenous bases. Inorganic Chemistry 1981, 20:1274-1277.
4. Schofield K, Grimmet MR, Keene BR. Heteroaromatic Nitrogen Compounds – The Azoles. London: Cambridge University Press; 1976.
5. Sheldrick GM. A short history of SHELX. Acta Crystallogr (A) 2008, 64:112-122.
6. Альберт А. Физические методы в химии гетероцикличecких соединений. Москва: Химия, 1966. – 85 c.
7. Андреев В.П., Соболев П.С., Зайцев Д.О. Количественные корреляции, связывающие процессы // Журнал Органической химии. – 2012. – Т.48. – Вып.6. – С.776-783.
8. Андреев В.П., Соболев П.С. Молекулярные комплексы металлопорфиринов как модельная система исследования донорно-акцепторных взаимодействий n,v-типа. Петрозаводск: Издательство ПетрГУ, 2015. – 355 с.
9. Физическая химия / Под ред. Б.П. Никольского. Ленинград: Химия, 1987. – 880 с.
10. Тюкавкина Н.А., Бауков Ю.И., Зурабян С.Э. Биоорганическая химия. Москва: ГЭОТАР- Медиа, 2015. – 416 с.