Биомаркеры (англ. Biomarker) – система показателей, характеризующих взаимодействие организма с потенциально опасными агентами разной природы (физической, химической, биологической и т.д.). Термин введен Национальной академией наук США для биологического мониторинга населения. Биомаркеры позволяют анализировать предполагаемый механизм того или иного процесса или токсикологическую модель. Они выявляют лиц с повышенным риском, т. е. с повышенным содержанием в организме тех или иных опасных веществ, обеспечивают большую точность при оценке экспозиции к воздействию и дают возможность оценить правильность фармако-кинетических моделей. В современной медицине термин «биомаркеры» часто заменяют на термин «предикторы», однако, первый представляет собой более широкое понятие. Существует множество классификаций биомаркеров. Наиболее информативная делит их следующим образом: 1) диагностические (позволяют признать наличие болезни, ее степень и насколько она прогрессировала); 2) прогностические (определяют или помогают определить вероятность развития и рецидива болезни); 3) предсказательные (позволяют оценить степень эффективности и безопасности лекарственных препаратов). Однако необходимо учитывать тот факт, что одни и те же биомаркеры могут обладать разными свойствами. Использование биомаркеров является неотъемлемой частью при оценке степени развития тех или иных заболеваний в организме, в том числе онкологических.
Несмотря на значительные успехи современной медицины в разработке методов профилактики, ранней диагностики и терапии злокачественных новообразований, рак шейки матки (РШМ) по-прежнему остается одной из главных причин смертности женщин от онкологических заболеваний. В течение двух последних десятилетий в России отмечается существенный прирост показателей инфицированности населения вирусом папилломы человека (ВПЧ) и числа заболевших РШМ, особенно среди женщин моложе 45 лет (Мерабишвили, 2012). Развитие скрининговых программ способствует снижению смертности от РШМ, в первую очередь, за счет увеличения частоты выявления ранних, доклинических форм рака и дисплазий.
В настоящее время предложены новые молекулярно-биологические тесты, направленные на определение активности ВПЧ и оценку ближайших перспектив течения инфекции. Биомаркеры, выявляемые данными тестами, подразделяют на 2 группы: компоненты продукции вируса папилломы и компоненты клетки-хозяина. Примерами служат PreTect HPV-Proofer (NorChip), разработанный для определения полноразмерной мРНК генов Е6 и Е7 ВПЧ, присутствие которой в клиническом материале, как полагают, ассоциировано с повышенным риском неопластической прогрессии (Рисунок 1), а также тест CINtec p16ink4a, который представляет собой маркер цервикального дискариоза, созданный как показатель изменения состояния клетки-хозяина. Считается, что сверхэкспрессия p16ink4a происходит вследствие инактивации гена ретинобластомы онкогенным белком вируса Е7. Использование данного биомаркера для диагностики цервикальных интраэпителиальных неоплазий (CIN) может значительно снизить количество неясных цитологических мазков при скрининге и помочь в установке диагноза и оценке прогноза течения инфекции.
Кроме вышеуказанных, в качестве возможных (перспективных) биомаркеров тераностики РШМ в настоящее время могут рассматриваться следующие группы биомолекул:
1) ростовые факторы, например, семейство факторов роста эндотелия сосудов VEGF, семейство ангиопоэтинов, плацентарный фактор роста PIGF, тромбоцитарный фактор роста PDGF / тимидин-фосфорилаза, фактор роста гепатоцитов, фактор роста фибробластов bFGF, эпидермальный фактор роста EGF, ангиогенин;
2) рецепторы перечисленных факторов роста;
3) про-ангиогенные цитокины, например, интерлейкины -8, -6, -1 α/β, трансформирующие факторы роста TGFα/β, фактор некроза опухолей TNFα;
4) эндогенные ингибиторы ангиогенеза, например, тромбоспондины -1, -2, интерферон-γ-индуцируемый протеин 10 IP-10, эндостатин и ангиостатин;
5) специфические лимфангиогенные факторы, в частности подопланин, 5’-нуклеотидаза, Prox1, LYVE-1;
6) белки и ферменты, участвующие в передаче сигнала апоптоза, напиример, р53, каспазы, белки семейства Bcl-2.
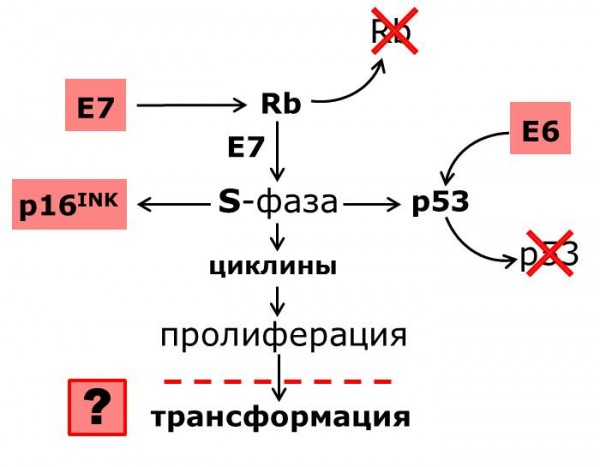
Рисунок 1. Молекулярные биомаркеры вирусного и клеточного происхождения – взаимосвязь с механизмом развития РШМ (Ibeanu, 2011).
Figure 1. Molecular biomarkers of viral and cellular origin – interrelationship with the mechanism of cervical cancer development (Ibeanu, 2011).
Клеточными биомаркерами (лимф)ангиогенеза и, соответственно, метастазирования могут служить циркулирующие эндотелиальные клетки или их предшественники, а также циркулирующие опухолевые клетки. Их обнаружение в периферической крови пациенток и количественный анализ возможны при использовании проточной цитофлуориметрии и специфических антител к маркерам клеток эндотелиального (например, CD34, CD106, CD133, CD146) и эпителиального (например, цитокератины, ЕрСАМ) происхождения.
В роли биомаркеров, характеризующих множественную лекарственную устойчивость (МЛУ) опухолевых клеток, рассматривается экспрессия членов семейства АВС-транспортеров – ключевых систем активного транспорта различных гидрофобных соединений, в том числе химиопрепаратов: ABC-B1 (Р-гликопротеин, или MDR1), ABC-C1 (MRP1), ABC-G2 (BCRP).
В качестве биомаркеров, характеризующих иммунный статус пациентки, могут выступать: изменение субпопуляционного состава циркулирующих лейкоцитов или лейкоцитов, инфильтрирующих очаг опухоли; изменение спектра поверхностных CD-маркеров (например, каких-либо активирующих рецепторов) и изменение функциональной активности определенной субпопуляции лейкоцитов (Волкова, 2012). Изменение численности и фенотипа циркулирующих натуральных киллеров возможно на основе анализа экспрессии специфических маркеров дифференцировки, в частности CD56, CD94/NKG2, NKp30, NKp44.
Проведенные нами исследования позволяют предположить, что молекулярный профиль CIN/РШМ может быть создан на основе определенного, адекватного количества биомаркеров с помощью высокотехнологичных методик и оборудования, которые доступны в условиях современно оснащенной клинической лаборатории. Этот спектр биомаркеров должен охватывать все основные особенности поведения опухолевых клеток РШМ: высокая скорость пролиферации, устойчивость к запрограммированной клеточной гибели и действию цитостатических/цитотоксических агентов, формирование собственной капиллярной и лимфатической сети, эпителиально-мезенхимное превращение (ЕМП) и утрата дифференцировочной программы, способность проникать за пределы базальной мембраны и метастазировать, ВПЧ-статус (Рисунок 2). Каждый потенциальный биомаркер должен быть исследован как минимум в трехуровневой системе: ТРАНСКРИПЦИЯ – ТРАНСЛЯЦИЯ – ПОСТТРАНСЛЯЦИОННЫЕ ИЗМЕНЕНИЯ. Только в этом случае можно получить полную картину функционирования биомолекулы, которая претендует на роль биомаркера.
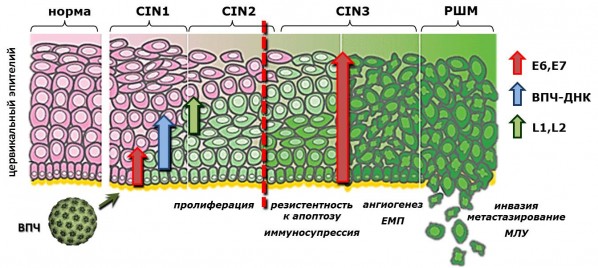
Рисунок 2. Изменение молекулярного профиля на различных этапах развития РШМ. Цветными стрелками показана экспрессия маркеров вирусного происхождения (длина стрелки отражает уровень и локализацию экспрессии). L1, L2 – белки капсида ВПЧ. Красной пунктирной линией отмечен этап интеграции вирусного генома в геном клетки-хозяина, который предположительно служит демаркационной линией между доброкачественными и злокачественными изменениями (Gius, 2007; Doorbar, 2006).
Figure 2. The change of molecular profile at different steps of cervical cancer development. Colored arrows show expression of viral markers (the length of an arrow corresponds to the level and location of expression). L1, L2 – viral capsid proteins. Red dotted line depicts the moment when viral DNA integrates into genome of a host cell, which is presumably a borderline between benign and malignant lesions (Gius, 2007; Doorbar, 2006).
Достоверное установление ассоциации папилломавирусов с развитием генитальной неоплазии позволило вплотную подойти к возможности анализировать сложные и спорные вопросы корреляции вызываемых ВПЧ молекулярно-генетических изменений с клиническими особенностями и прогнозом РШМ. На клиническое течение РШМ оказывают влияние гистологический тип и степень дифференцировки опухоли, размер первичной опухоли, глубина инвазии подлежащих тканей и вовлечение в опухолевый процесс прилежащих к шейке матки тканей, лимфососудистого пространства и регионарных лимфоузлов, а также формирование множественной лекарственной устойчивости. Прогноз РШМ ухудшают большие размеры первичной опухоли, низкая степень дифференцировки опухоли, наличие метастатического поражения регионарных лимфоузлов, молодой возраст больных (Ikenberg, 1994; Бахлаев, 2012). Сообщения, соотносящие молекулярно-генетические детерминанты ВПЧ-инфекции при РШМ с гистопатологическими и клиническими особенностями опухолей и прогнозом РШМ, содержат противоречивые результаты. ВПЧ типа 16 чаще встречается в высокодифференцированных плоскоклеточных опухолях, в то время как ВПЧ типа 18 ассоциирован с плоскоклеточными опухолями низкой степени дифференцировки и аденокарциномами (Соловьев, 2011). Не исключено, что базовые предиктивные и прогностические биомаркеры при разном гистогенезе будут неоднотипными.
РШМ уникален тем, что многие процессы индуцируются или ингибируются вирусными онкогенами. Поскольку сверхэкспрессия онкогенов ВПЧ наблюдается при CIN2−3, можно предположить, что необратимое формирование молекулярного портрета будущей опухоли начинается еще на этапе дисплазии легкой/средней степени тяжести, но фундаментальная и клиническая значимость данного предположения требует экспериментального подтверждения.
Таким образом, для повышения эффективности терапии РШМ существует необходимость в комплексе биомаркеров, которые удовлетворяют следующим условиям: а) связаны с клинико-патологическими характеристиками развития заболевания; б) отражают состояние противоопухолевого иммунитета; в) всесторонне описывают ангиогенный потенциал и признаки МЛУ в каждом индивидуальном случае дисплазии или РШМ; г) удобны для клинического применения с целью составления индивидуального курса терапии и прогноза развития РШМ. Кроме того, в отношении любого биомаркера важны низкая биологическая вариабельность, специфичность, воспроизводимость, однозначность интерпретации, доступность, возможность использования автоматических аналитических систем, низкая стоимость, высокие показатели прогнозирующей ценности и отношения правдоподобия положительного результата теста.
Имеющиеся базы данных по генам, вовлеченным в прогрессию ВПЧ-инфекции и канцерогенез, в будущем могут помочь не только в решении исследовательских задач, но и в составлении индивидуального прогноза при развитии и прогрессии заболевания, в подборе комплексной терапии с применением методов генотерапии и биотерапии РШМ и, как следствие, в повышении безрецидивной и общей выживаемости пациенток.
Благодарности
Работа выполнена при финансовой поддержке гранта Правительства РФ (Постановление 220), № 11.G34.31.0052, и гранта РФФИ №НК 14-04-32098\14.
Библиография
1. Bakhlaev IE, Kovchur PI, Mikhetko AA, Volkova TO. Cervical Cancer in Karelia. Petrozavodsk: Petrozavodsk State University Press; 2012.
2. Doorbar J. Molecular biology of human papillomavirus infection and cervical cancer. Clinical Science 2006, 110:525-541.
3. Gius D, Funk MC, Chuang EY, Feng S, Huettner PC, Nguyen L, Bradbury CM, Mishra M, Gao S, Buttin BM, Cohn DE, Powell MA, Horowitz NS, Whitcomb BP, Rader JS. Profiling microdissected epithelium and stroma to model genomic signatures for cervical carcinogenesis accommodating for covariates. Cancer Res 2007, 67:7113-7123.
4. Ibeanu OA. Molecular pathogenesis of cervical cancer. Cancer Biology and Therapy 2011, 11(3):295-306.
5. Ikenberg H, Sauerbrei W, Schottmüller U, Spitz C, Pfleiderer A. Human papillomavirus DNA in cervical carcinoma – correlation with clinical data and influence on prognosis. Int J Cancer 1994, 59(3):322-326.
6. Мерабишвили, В.М., Лалианци, Э.И., Субботина О.Ю. Рак шейки матки: заболеваемость, смертность (популяционное исследование) // Вопросы онкологии. − 2012. − Т.58. − №1. − С.41-44.